In de reactie met ammoniak, waarom is water het zuur?
Dit is een geweldige algemene scheikundige reactie met belangrijke organische scheikundige implicaties. Een andere soortgelijke vraag is, waarom is water een base als het reageert met een “zuur”? Het antwoord op beide vragen is: het is allemaal relatief! Hier bij StudyOrgo krijgen we vaak vragen als deze over onderwerpen in de organische chemie die meestal snel worden behandeld, slecht worden beschreven of waarvan je verwacht dat je ze kent uit eerdere cursussen. Deze concepten zijn echt belangrijk voor het begrijpen van de complexere onderwerpen die komen. Met een lidmaatschap bij StudyOrgo krijg je nog meer tips en trucs over organische chemie onderwerpen en gedetailleerde mechanismen met uitleg. De blog van vandaag is een voorproefje van de gedetailleerde onderwerpen en materialen die beschikbaar zijn. Bekijk een lidmaatschap van StudyOrgo.com en meld je vandaag nog aan!
Houd in gedachten dat er in termen van zuren en basen twee definities zijn; de Bronsted- en Lewis-definitie. Bronsted zuren worden gedefinieerd als proton donors, terwijl Lewis zuren worden gedefinieerd als elektron acceptors. Beide zijn zuren, maar waar we verschillend over denken is of er protonen of elektronen bij betrokken zijn. In een waterige oplossing, algemene chemie of biochemie, denken wij hoofdzakelijk aan de Bronsted-definitie omdat de dissociatie van protonen van zuren de oplossingsconcentratie van H+ verandert, wat wij interpreteren als een verandering in pH en de “zuurgraad” van de oplossing. Wij meten de dissociatie van de protonen van zuren, of de aanvaarding van protonen door basen, met een numerieke waarde die de pKa is. Hoe groter de pKa, hoe zwakker het zuur en hoe sterker de base. Hoe lager de pKa, hoe sterker het zuur en hoe zwakker de base. Een gemakkelijke truc om aan pKa te denken is, de geprotoneerde versie van het molecuul aan de linkerkant te plaatsen en het te zien als een proton-donor. De pKa vertelt je hoe gemakkelijk deze donatie zal zijn, hoe lager het getal hoe gemakkelijker de protondonatie.
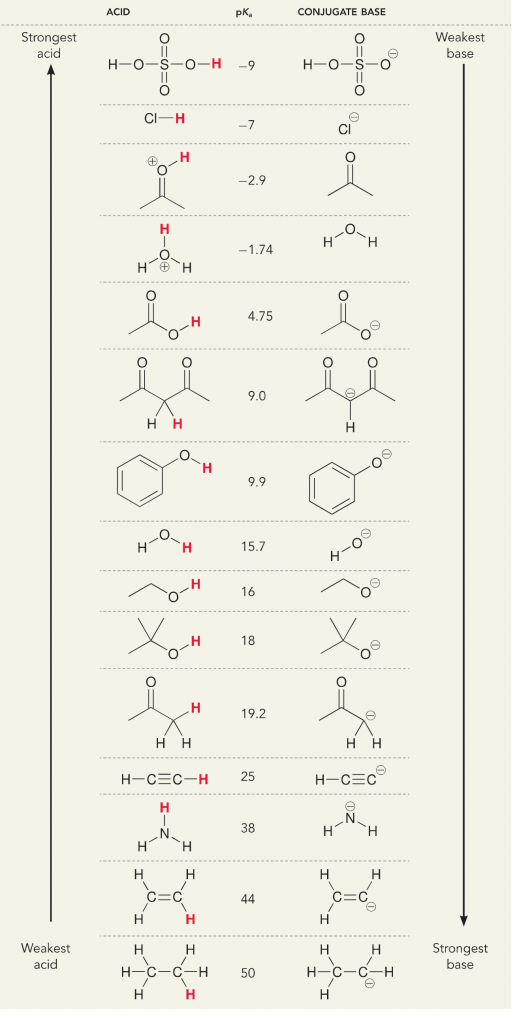
Laten we eens kijken naar de reactie van ammoniak en water; de pKa voor water is gedefinieerd als 14. De pKa voor ammoniak is ~37.
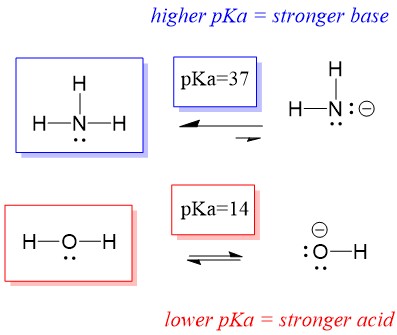
Dus omdat de pKa van water lager is dan die van ammoniak, is het een sterker zuur dan ammoniak en zal het protonen afstaan aan de ammoniakbasis. Deze reactie leidt ertoe dat water de geconjugeerde base OH- wordt en ammoniak het geconjugeerde zuur NH4+. Interessant genoeg is dit de reden waarom ammoniak een bijtend middel is, het produceert hydroxide dat reageert met vlekken en micro-organismen om huishoudelijke voorwerpen effectief schoon te maken en te ontsmetten.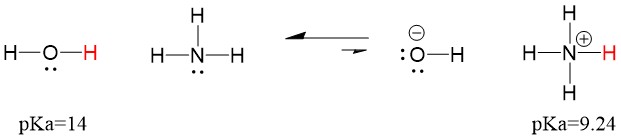
Dit is belangrijk als organisch scheikundig concept omdat de sterkte van zuren en basen in termen van elektronen, of de Lewis-definitie, precies is hoe we denken over mechanismen van het breken en vormen van bindingen; de stroom van elektronen. De sterkte van de Lewis-zuren en het geconjugeerde zuur kunnen helpen bepalen in welke richting een reactie zal verlopen. We kunnen zien dat de reactie van water en ammoniak ongunstig is, maar in werkelijkheid komt er genoeg van de reactie voor om de pH van water aanzienlijk te verlagen (pH~11 met ammoniak).
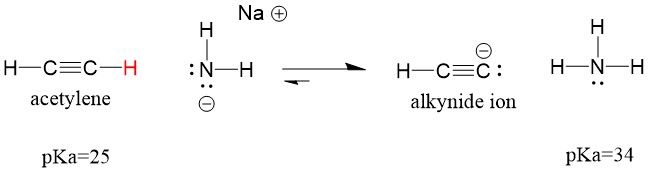
Laten we eens kijken naar een acetyleen dat reageert met een base om een alkynide-ion te genereren, een nuttig nucleofiel voor C-C bindingsvorming. Als we proberen om natriumhydroxide te laten reageren met alkyne, zal er GEEN alkynide-ion gevormd worden. Dit komt omdat het geconjugeerde zure product van de reactie water is, dat een pKa van 15 heeft, en dus STERKER is dan het oorspronkelijke zure acetyleen (pKa = 25). Reacties geven ALTIJD de voorkeur aan de vorming van het zwakkere zuur, of in dit geval, aan de kant van het reagens.
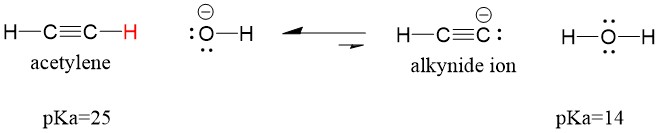
Als we onze base veranderen in natriumamide, wat een veel sterkere base is, ZAL er een alkynide-ion worden gevormd. Dit komt omdat het geconjugeerde zure product van de reactie ammoniak is, dat een pKa van 38 heeft, en een WAKKER geconjugeerd zuur is dan het oorspronkelijke zuur acetyleen (pKa = 25). In dit geval heeft de reactie een voorkeur voor de productzijde!

Geef een antwoord