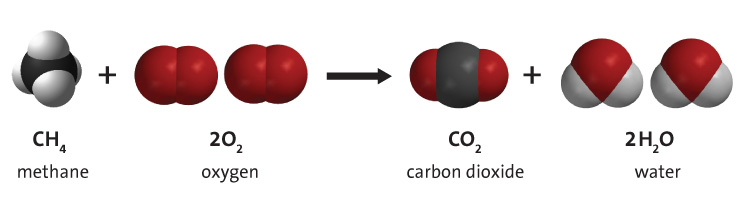
Verbranding van koolwaterstoffen is de chemische reactie waarbij een koolwaterstof met zuurstof reageert, waarbij kooldioxide, water en warmte ontstaan. Koolwaterstoffen zijn moleculen die zowel uit waterstof als koolstof bestaan. Ze zijn het meest bekend als het hoofdbestanddeel van fossiele brandstoffen, namelijk aardgas, aardolie en steenkool. Om deze reden worden fossiele brandstoffen vaak koolwaterstofbronnen genoemd. Energie wordt uit fossiele brandstoffen verkregen door verbranding (combustion) van de brandstof. Hoewel fossiele brandstoffen onzuiverheden bevatten, is de verbranding van koolwaterstoffen het primaire proces bij de verbranding van fossiele brandstoffen. Een voorbeeld van de verbranding van koolwaterstoffen is afgebeeld in figuur 1. Zie simulatie onderaan de pagina voor meer voorbeelden.
Beschrijving
Overschillig welk type koolwaterstof, verbranding met zuurstof levert 3 producten op: kooldioxide, water en warmte, zoals in onderstaande algemene reactie is weergegeven. De energie die nodig is om de bindingen in de koolwaterstofmoleculen te verbreken, is aanzienlijk lager dan de energie die vrijkomt bij de vorming van de bindingen in de CO2- en H2O-moleculen. Daarom komt bij dit proces een aanzienlijke hoeveelheid thermische energie (warmte) vrij. Deze thermische energie kan rechtstreeks worden gebruikt (bijvoorbeeld om een huis te verwarmen) of kan worden omgezet in mechanische energie, met behulp van een warmtemotor. Dit is echter onderhevig aan efficiëntieverlies, wat resulteert in de nodige aanzienlijke energieverliezen (als afvalwarmte) beheerst door de tweede wet van de thermodynamica. De resulterende nuttige mechanische energie zal veel minder zijn dan de aanvankelijke thermische energie die door de koolwaterstofverbranding wordt geleverd.
Algemene reactievergelijking:
- verwijst naar het aantal koolstofatomen in de koolwaterstof
- verwijst naar het aantal waterstofatomen in de koolwaterstof
- verwijst naar het aantal zuurstofatomen dat nodig is in de verbrandingsreactie van koolwaterstof
Koolwaterstofverbranding en fossiele brandstoffen
Merk op dat CO2 altijd wordt geproduceerd bij de verbranding van koolwaterstof; het maakt niet uit welk type koolwaterstofmolecuul. De productie van CO2 en H2O is in feite de manier waarop nuttige energie wordt verkregen uit fossiele brandstoffen. Daarom is het belangrijk onderscheid te maken tussen koolstofdioxide en andere “afvalproducten” die ontstaan uit onzuiverheden in de brandstof, zoals zwavel- en stikstofverbindingen. Afvalstoffen die voortkomen uit onzuiverheden kunnen met de juiste technologie worden geëlimineerd; CO2 kan niet worden geëlimineerd tenzij de fossiele brandstoffen in de eerste plaats niet worden verbrand (gebruikt).
Niet alle fossiele brandstoffen hebben dezelfde samenstelling. Aardgas bestaat voor meer dan 90% uit methaan (CH4), de kleinste koolwaterstofmolecule. Olie bestaat meestal uit middelgrote moleculen, hoewel de samenstelling sterk varieert van de ene soort ruwe olie tot de andere. In het algemeen geldt dat hoe dichter de olie is, hoe langer de koolstofketens in de moleculen zijn. Steenkool tenslotte bevat de grootste en meest complexe koolwaterstofmoleculen.
Omdat verschillende koolwaterstoffen verschillende verhoudingen waterstof-koolstof hebben, produceren zij verschillende verhoudingen water-kooldioxide. In het algemeen geldt: hoe langer en complexer de molecule, des te groter de verhouding tussen koolstof en waterstof. Daarom zal verbranding van gelijke hoeveelheden van verschillende koolwaterstoffen verschillende hoeveelheden kooldioxide opleveren, afhankelijk van de verhouding tussen koolstof en waterstof in de moleculen van elk van beide. Aangezien steenkool de langste en meest complexe koolwaterstofmoleculen bevat, komt bij verbranding van steenkool meer CO2 vrij dan bij verbranding van dezelfde massa aardolie of aardgas. Hierdoor verandert ook de energiedichtheid van elk van deze brandstoffen.
Koolstofdioxide-emissies
Hieronder ziet u een grafiek van de CO2 die vrijkomt bij de productie van 293,1 kWh (1.000.000 BTU) energie uit verschillende koolwaterstofbrandstoffen.
| brandstof | kg CO2-uitstoot |
|---|---|
| Anthraciet Steenkool | 104 |
| Bitumineuze Steenkool | 93.5 |
| bruinkool | 97.9 |
| Subbitumineuze steenkool | 97.4 |
| Diesel | 73.2 |
| benzine | 71.5 |
| propaan | 63.2 |
| Natuurgas | 53.2 |
Verbrandingsanimatie
Kies een brandstof uit het uitklapmenu om de nettoreactie te zien die bij verbranding optreedt.
Voor verdere lectuur
Voor verdere informatie zie de verwante pagina’s hieronder:
- Fossiele brandstof
- Primaire energie
- Koolwaterstofbron
- Kolen
- Olie
- Natuurlijk gas
- Een willekeurige pagina
Geef een antwoord