|
|
Dit artikel heeft meerdere problemen. Help het te verbeteren of bespreek deze problemen op de overlegpagina. (Leer hoe en wanneer u deze sjabloonberichten verwijdert)
(Leer hoe en wanneer u dit sjabloonbericht verwijdert) |
Monosacchariden (van Grieks monos: enkel, sacchar: suiker), ook wel enkelvoudige suikers genoemd, zijn de eenvoudigste vorm van suiker en de meest basale eenheden (monomeren) van koolhydraten. De algemene formule is C
nH
2nO
n, hoewel niet alle moleculen die aan deze formule voldoen (b.v. azijnzuur) koolhydraten zijn. Het zijn gewoonlijk kleurloze, in water oplosbare en kristallijne vaste stoffen. In tegenstelling tot hun naam (suikers) hebben slechts sommige monosacchariden een zoete smaak.
Voorbeelden van monosacchariden zijn glucose (dextrose), fructose (levulose), en galactose. Monosacchariden zijn de bouwstenen van disacchariden (zoals sucrose en lactose) en polysacchariden (zoals cellulose en zetmeel). Elk koolstofatoom dat een hydroxylgroep ondersteunt is chiraal, behalve die aan het eind van de keten. Dit geeft aanleiding tot een aantal isomere vormen, alle met dezelfde chemische formule. Zo zijn galactose en glucose beide aldohexosen, maar hebben verschillende fysische structuren en chemische eigenschappen.
De monosacharide glucose speelt een centrale rol in het metabolisme, waar de chemische energie wordt onttrokken via de glycolyse en de citroenzuurcyclus om levende organismen van energie te voorzien. Sommige andere monosachariden kunnen in het levende organisme worden omgezet in glucose.
Structuur en nomenclatuur
Op enkele uitzonderingen na (b.v. deoxyribose), hebben monosachariden deze chemische formule: (CH2O)x, waarbij gewoonlijk x ≥ 3. Monosacchariden kunnen worden ingedeeld naar het aantal x koolstofatomen dat zij bevatten: triose (3), tetrose (4), pentose (5), hexose (6), heptose (7), enzovoort.
Glucose, gebruikt als energiebron en voor de synthese van zetmeel, glycogeen en cellulose, is een hexose. Ribose en desoxyribose (in respectievelijk RNA en DNA) zijn pentose suikers. Voorbeelden van heptosen zijn de ketosen, mannoheptulose en sedoheptulose. Monosacchariden met acht of meer koolhydraten worden zelden waargenomen, omdat zij vrij onstabiel zijn. In waterige oplossingen bestaan monosachariden als ringen als ze meer dan vier koolstofatomen hebben.
Lineaire-keten monosachariden
Simpel monosachariden hebben een lineair en onvertakt koolstofskelet met één carbonyl (C=O) functionele groep, en één hydroxyl (OH) groep op elk van de resterende koolstofatomen. Daarom kan de moleculaire structuur van een eenvoudige monosaccharide worden geschreven als H(CHOH)n(C=O)(CHOH)mH, waarbij n + 1 + m = x; zodat de elementaire formule CxH2xOx.
Bij conventie worden de koolstofatomen genummerd van 1 tot x langs de ruggengraat, te beginnen bij het uiteinde dat het dichtst bij de C=O-groep ligt. Monosacchariden zijn de eenvoudigste eenheden van koolhydraten en de eenvoudigste vorm van suiker.
Als de carbonyl op positie 1 zit (dat wil zeggen, n of m is nul), begint het molecuul met een formylgroep H(C=O)- en is het technisch gezien een aldehyde. In dat geval wordt de verbinding een aldose genoemd. In het andere geval heeft het molecuul een ketogroep, een carbonyl -(C=O)- tussen twee koolstofatomen; dan is het formeel een keton, en wordt het een ketose genoemd. Ketoses van biologisch belang hebben meestal de carbonyl op positie 2.
De verschillende classificaties hierboven kunnen worden gecombineerd, wat resulteert in namen als “aldohexose” en “ketotriose”.
Een meer algemene nomenclatuur voor open-keten monosachariden combineert een Grieks voorvoegsel om het aantal koolstofatomen aan te geven (tri-, tetr-, pent-, hex-, enz.) met de achtervoegsels “-ose” voor aldosen en “-ulose” voor ketosen. In het laatste geval, als de carbonyl niet op positie 2 zit, wordt zijn positie aangegeven met een numeriek infix. Zo is bijvoorbeeld H(C=O)(CHOH)4H pentose, H(CHOH)(C=O)(CHOH)3H pentulose, en H(CHOH)2(C=O)(CHOH)2H pent-3-ulose.
Open-keten stereoisomeren
Twee monosacchariden met gelijkwaardige molecuulgrafieken (zelfde ketenlengte en zelfde carbonylpositie) kunnen toch verschillende stereoisomeren zijn, waarvan de moleculen verschillen in ruimtelijke oriëntatie. Dit gebeurt alleen als de molecule een stereogeen centrum bevat, met name een koolstofatoom dat chiraal is (verbonden met vier verschillende moleculaire substructuren). Deze vier bindingen kunnen twee ruimtelijke configuraties hebben die zich van elkaar onderscheiden door hun handigheid. In een eenvoudige open-keten monosacharide is elke koolstof chiraal, behalve het eerste en het laatste atoom van de keten, en (in ketoses) de koolstof met de keto groep.
Bij voorbeeld, de triketose H(CHOH)(C=O)(CHOH)H (glyceron, dihydroxyaceton) heeft geen stereogeen centrum, en bestaat dus als een enkele stereoisomeer. De andere triose, de aldose H(C=O)(CHOH)2H (glyceraldehyde), heeft één chirale koolstof – de centrale, nummer 2 – die gebonden is aan de groepen -H, -OH, -C(OH)H2, en -(C=O)H. Daarom bestaat het als twee stereoisomeren waarvan de moleculen elkaars spiegelbeeld zijn (zoals een linker- en een rechterhandschoen). Monosachariden met vier of meer koolstofatomen kunnen meerdere chirale koolstofatomen bevatten, zodat zij meestal meer dan twee stereoisomeren hebben. Het aantal verschillende stereoisomeren met hetzelfde diagram is begrensd door 2c, waarbij c het totale aantal chirale carbons is.
De Fischer projectie is een systematische manier om de skeletformule van een acyclische monosaccharide te tekenen, zodat de handigheid van elke chirale koolstof goed gespecificeerd is. Elke stereoisomeer van een eenvoudige open-keten monosacharide kan worden geïdentificeerd aan de hand van de posities (rechts of links) in het Fischer-diagram van de chirale hydroxyls (de hydroxyls die aan de chirale koolstofatomen vastzitten).
De meeste stereoisomeren zijn zelf chiraal (te onderscheiden van hun spiegelbeelden). In de Fischer-projectie verschillen twee spiegelbeeldisomeren doordat de posities van alle chirale hydroxyls van rechts naar links zijn omgedraaid. Spiegelbeeldisomeren zijn chemisch identiek in niet-chirale omgevingen, maar hebben gewoonlijk zeer verschillende biochemische eigenschappen en komen in de natuur voor.
Hoewel de meeste stereoisomeren in paren van spiegelbeeldige vormen kunnen worden gerangschikt, zijn er sommige niet-chirale stereoisomeren die identiek zijn aan hun spiegelbeelden, ondanks het feit dat ze chirale centra hebben. Dit gebeurt wanneer de molecuulgrafiek symmetrisch is, zoals bij de 3-ketopentosen H(CHOH)2(CO)(CHOH)2H, en de twee helften spiegelbeelden van elkaar zijn. In dat geval is spiegelen gelijk aan een halve draaiing. Om deze reden zijn er slechts drie verschillende 3-ketopentose stereoisomeren, ook al heeft het molecuul twee chirale koolstofatomen.
Distinctieve stereoisomeren die geen spiegelbeelden van elkaar zijn, hebben gewoonlijk verschillende chemische eigenschappen, zelfs in een niet-chirale omgeving. Daarom kan aan elk spiegelpaar en elke niet-chirale stereoisomeer een specifieke monosaccharidennaam worden gegeven. Er zijn bijvoorbeeld 16 verschillende aldohexose stereoisomeren, maar de naam “glucose” betekent een specifiek paar spiegelbeeldige aldohexosen. In de Fischer-projectie heeft één van de twee glucose-isomeren de hydroxyl links op C3, en rechts op C4 en C5; terwijl de andere isomeer het omgekeerde patroon heeft. Deze specifieke monosaccharidenamen hebben conventionele drieletter-afkortingen, zoals “Glu” voor glucose en “Thr” voor threose.
In het algemeen heeft een monosaccharide met n asymmetrische carbons 2n stereoisomeren. Het aantal open keten stereoisomeren voor een aldose monosaccharide is één groter dan dat van een ketose monosaccharide van dezelfde lengte. Elke ketose zal 2(n-3) stereoisomeren hebben waarbij n > 2 het aantal carbons is. Elke aldose zal 2(n-2) stereoisomeren hebben waarbij n > 2 het aantal carbons is. Deze worden ook wel epimeren genoemd die de verschillende rangschikking van -OH en -H groepen op de asymmetrische of chirale koolstofatomen hebben (dit geldt niet voor de carbons met de functionele groep carbonyl).
Configuratie van monosacchariden
Zoals vele chirale moleculen, zullen de twee stereoisomeren van glyceraldehyde de polarisatierichting van lineair gepolariseerd licht geleidelijk draaien als het er doorheen gaat, zelfs in oplossing. De twee stereoisomeren worden aangeduid met de voorvoegsels D- en L-, al naar gelang de richting van de draaiing: D-glyceraldehyde is dextroroterend (draait de polarisatie-as met de klok mee), terwijl L-glyceraldehyde levoroterend is (draait de polarisatie-as tegen de klok in).

De D- en L- voorvoegsels worden ook gebruikt bij andere monosachariden, om twee bepaalde stereoisomeren te onderscheiden die spiegelbeelden van elkaar zijn. Daartoe beschouwt men de chirale koolstof die het verst van de C=O groep verwijderd is. Zijn vier bindingen moeten verbinding maken met -H, -OH, -C(OH)H, en de rest van het molecuul. Als het molecuul in de ruimte kan worden geroteerd zodat de richtingen van deze vier groepen overeenkomen met die van de analoge groepen in C2 van D-glyceraldehyde, dan krijgt het isomeer het D-voorvoegsel. Anders krijgt het het L- voorvoegsel.
In de Fischer projectie geven de D- en L- voorvoegsels de configuratie aan van het koolstofatoom dat als tweede van onderen staat: D- als de hydroxyl zich aan de rechterkant bevindt, en L- als deze zich aan de linkerkant bevindt.
Merk op dat de D- en L- voorvoegsels niet de draairichting van gepolariseerd licht aangeven, die een gecombineerd effect is van de opstelling in alle chirale centra. De twee enantiomeren zullen het licht echter altijd in tegengestelde richtingen roteren, in dezelfde mate. Zie ook D/L-systeem.
Cyclisatie van monosacchariden
Een monosaccharide gaat vaak over van de acyclische (open-keten) vorm in een cyclische vorm, door een nucleofiele additiereactie tussen de carbonylgroep en een van de hydroxyls van hetzelfde molecuul. Door de reactie ontstaat een ring van koolstofatomen die wordt gesloten door één overbruggend zuurstofatoom. Het resulterende molecuul heeft een hemiacetaal- of hemiketaalgroep, afhankelijk van de vraag of de lineaire vorm een aldose of een ketose was. De reactie is gemakkelijk omkeerbaar, waarbij de oorspronkelijke open-keten vorm ontstaat.
In deze cyclische vormen heeft de ring gewoonlijk vijf of zes atomen. Deze vormen worden respectievelijk furanosen en pyranosen genoemd – naar analogie van furan en pyran, de eenvoudigste verbindingen met dezelfde koolstof-zuurstofring (hoewel zij de dubbele bindingen van deze twee moleculen missen). Zo kan bijvoorbeeld de aldohexose glucose een hemiacetaalverbinding vormen tussen de hydroxyl op koolstof 1 en de zuurstof op koolstof 4, waardoor een molecuul met een ring met 5 leden ontstaat, glucofuranose genaamd. Dezelfde reactie kan plaatsvinden tussen de koolstofnoten 1 en 5, waardoor een molecuul met een ring met 6 leden ontstaat, glucopyranose genaamd. Cyclische vormen met een zeven-atomige ring (dezelfde als van oxepaan), die zelden voorkomen, worden heptosen genoemd.



Voor veel monosacchariden (waaronder glucose), overheersen de cyclische vormen, in vaste toestand en in oplossingen, en daarom wordt gewoonlijk dezelfde naam gebruikt voor de open- en gesloten-ketenisomeren. Zo kan de term “glucose” bijvoorbeeld glucofuranose, glucopyranose, de open-keten vorm, of een mengsel van de drie betekenen.
Cyclisatie creëert een nieuw stereogeen centrum op de carbonyl-dragende koolstof. De -OH groep die de zuurstof van de carbonyl vervangt, kan op twee verschillende posities ten opzichte van het middenvlak van de ring terechtkomen. Zo levert elke open-keten monosacharide twee cyclische isomeren (anomeren) op, aangeduid met de voorvoegsels α- en β-. Het molecuul kan tussen deze twee vormen wisselen door een proces dat mutarotatie wordt genoemd, dat bestaat uit een omkering van de ringvormende reactie gevolgd door een andere ringvorming.
Haworth projectie
De stereochemische structuur van een cyclische monosacharide kan worden weergegeven in een Haworth projectie. In dit diagram heeft de α-isomeer voor de pyranosevorm van een D-aldohexose de -OH van de anomere koolstof onder het vlak van de koolstofatomen, terwijl de β-isomeer de -OH van de anomere koolstof boven het vlak heeft. Pyranosen nemen typisch een stoelconformatie aan, vergelijkbaar met die van cyclohexaan. In deze conformatie heeft de α-isomeer de -OH van de anomere koolstof in een axiale positie, terwijl de β-isomeer de -OH van de anomere koolstof in equatoriale positie heeft (gezien D-aldohexose suikers).
-
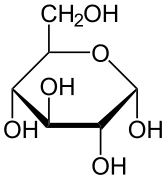
α-D-Glucopyranose
-

β-D-Glucopyranose
Derivaten
Er bestaat een groot aantal biologisch belangrijke gemodificeerde monosacchariden:
- Aminosuikers zoals:
- galactosamine
- glucosamine
- siaalzuur
- N-acetylglucosamine
- Sulfosuikers zoals:
- sulfoquinovose
- andere zoals:
- ascorbinezuur
- mannitol
- glucuronzuur
Zie ook
- Monosacchariden nomenclatuur
- suiker
- suikerzuur
- suikeralcohol
- disacharide
Opmerkingen
- ^ “Carbohydrates”. Chemie voor biologen. Koninklijke Vereniging voor Scheikunde. Op 10 maart 2017 ontleend.
- ^ NCERT TEXT BOOK CLaSS-12
- ^ “Carbohydrates”. Chemie voor biologen. Koninklijke Vereniging voor Chemie. Op 10 maart 2017 ontleend.
- ^ Pigman, William Ward; Anet, E. F. L. J. (1972). “Hoofdstuk 4: Mutarotaties en werkingen van zuren en basen”. In Pigman en Horton (ed.). De Koolhydraten: Chemistry and Biochemistry. 1A (2nd ed.). San Diego: Academic Press. pp. 165-194.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (het “gouden boek”) (1997). Online gecorrigeerde versie: (2006-) “Haworth representatie”. doi:10.1351/goldbook.H02749


Geef een antwoord