De Lewisstructuur van carbonaat ion wordt in deze handleiding stap voor stap getekend. Het totale valentie elektronen concept wordt gebruikt om de lewis structuur van CO32- te tekenen. Na het voltooien van de lewis-structuur van CO32-, moet er een -2 lading en een stabiliteit zijn. Hierover leer je meer in deze tutorial.
- Carbonaation | CO32-
- CO32- Lewisstructuur
- Stappen van het tekenen van de lewisstructuur van CO32-
- Totaal aantal elektronen van de valantieschillen van CO32-
- Totaal valentie-elektronenparen
- Centrumatoom van het CO32-ion
- Eenparen op atomen
- Ladingen op atomen
- controleer de stabiliteit en minimaliseer de ladingen op atomen door de eenzame paren in bindingen om te zetten
- Lewisstructuur van CO32-(carbonaat)ion
- carbonaat lewisstructuur en bicarbonaat lewisstructuur
Carbonaation | CO32-
Carbonaation heeft een -2 lading. Metaalcarbonaatverbindingen komen veel voor in de wereld. Als CaCO3 kan worden gegeven.
CO32- Lewisstructuur
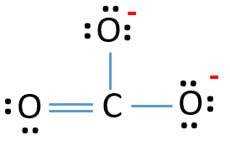
Er zijn drie σ-bindingen en π-binding rond het koolstofatoom in de Lewisstructuur van CO32- ion.
Stappen van het tekenen van de lewisstructuur van CO32-
De volgende stappen zijn nodig om de CO32- lewisstructuur te tekenen en ze worden in detail uitgelegd in dit leerprogramma.
- Vind totaal aantal elektronen van de valantieschillen van koolstof- en zuurstofatomen
- Totaal aantal elektronenparen
- Center atoom selectie
- Plaats eenzame paren op atomen
- Controleer de stabiliteit en minimaliseer de ladingen op atomen door eenzame paren om te zetten in bindingen.
Het tekenen van de juiste lewisstructuur is belangrijk om de resonantiestructuren van CO32- correct te tekenen.
Totaal aantal elektronen van de valantieschillen van CO32-
Koolstof bevindt zich in groep 4 van het periodiek systeem. Dus, koolstof heeft vier elektronen in zijn valantieschil.Zuurstof bevindt zich in de 6e groep. Het heeft zes elektronen in de valentieschil.
- Totale valentie-elektronen van het koolstofatoom = 4
Er zijn drie zuurstofatomen in het CO32-ion, dus
- Totale valentie-elektronen van het zuurstofatoom = 6 * 3 = 18
Er is een lading van -2 op het CO32-ion. Daarom zijn er nog twee elektronen die bijdragen aan de valentie-elektronen.
- Totaal valentie-elektronen = 4 + 18 + 2 = 24
Totaal valentie-elektronenparen
Totaal valantie-elektronenparen = σ-bindingen + π-bindingen + eenzame paren in valentieschillen
Totaal aantal elektronenparen wordt bepaald door het aantal totale valentie-elektronen door twee te delen. Voor het CO32-ion zijn de totale elektronenparen 12.
Centrumatoom van het CO32-ion
Om het centrumatoom te zijn, is het vermogen om een hogere valantie te hebben belangrijk. Koolstof heeft de meeste kans om het centrumatoom te zijn (zie de figuur) omdat koolstof een valentie van 4 kan hebben. De hoogste valentie van zuurstof is 2. Dus, nu kunnen we een schets maken van CO32- ion.
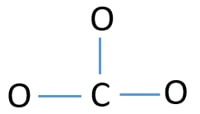
Eenparen op atomen
- Er zijn al drie C-O bindingen in de bovenstaande schets. Er blijven dus maar negen (12-3 = 9) valentie-elektronenparen over.
- Neerst markeert u die negen valentie-elektronenparen als lone pairs in buitenatomen (op zuurstofatomen). Eén zuurstofatoom zal drie eenzame paren opnemen volgens de octale regel (een zuurstofatoom kan niet meer dan acht elektronen in zijn valentieschil houden).
- Voor drie zuurstofatomen zijn negen elektronenparen opgebruikt. Na de markering van de zuurstofatomen (buiten de atomen) zijn er geen eenzame paren meer te markeren op de koolstofatomen.
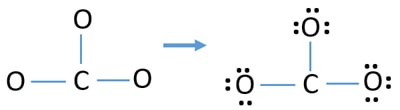
Ladingen op atomen
Na het markeren van elektronenparen op atomen, moeten we de ladingen van elk atoom markeren. Het markeren van ladingen is belangrijk omdat het wordt gebruikt om de beste lewisstructuur van het ion te bepalen. Na het markeren van de ladingen ziet u dat elk zuurstofatoom een -1 lading krijgt en het koolstofatoom een +1.
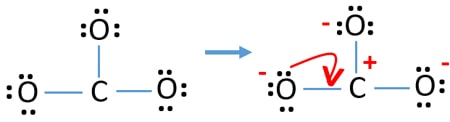
controleer de stabiliteit en minimaliseer de ladingen op atomen door de eenzame paren in bindingen om te zetten
- Zuurstofatomen moeten negatieve ladingen hebben omdat de elektronegativiteit van het zuurstofatoom hoger is dan die van het koolstofatoom. Anders kunnen we zeggen dat het vermogen om negatieve ladingen vast te houden groter is bij zuurstofatomen dan bij koolstofatomen.
- De getekende structuur is niet stabiel omdat alle atomen een lading hebben (de Lewis-structuur zou een stabiele structuur met minder ladingen moeten zijn).
- Nu moeten we proberen de ladingen te minimaliseren door een of meer eenparen om te zetten in bindingen. Dus één lone pair van één zuurstofatoom omzetten in een C-O binding.
- Nu is er een dubbele binding tussen een koolstofatoom en een zuurstofatoom (een C=O binding). Nu zijn er twee enkele bindingen tussen het koolstofatoom en de andere twee zuurstofatomen (twee C-O bindingen).
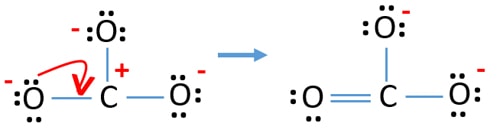
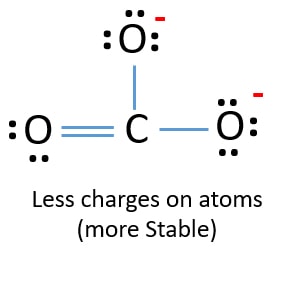
In de nieuwe structuur zijn de ladingen van de atomen verlaagd ten opzichte van de vorige structuur. Nu zijn er geen ladingen meer op één zuurstofatoom en het koolstofatoom. Ook hebben slechts twee zuurstofatomen -1 negatieve lading. Nu begrijp je dat deze structuur van CO32- stabieler is dan de vorige structuur. Deze structuur heeft dus meer kans om de Lewis-structuur van het CO32-ion te zijn.
Lewisstructuur van CO32-(carbonaat)ion
Vragen
Stel je scheikundevragen en vind de antwoorden
carbonaat lewisstructuur en bicarbonaat lewisstructuur
In carbonaat ion zitten twee zuurstofatomen die elk een -1 lading hebben. Een van deze zuurstofatomen neemt een proton (H+ ion) en vormt een -OH groep.
Gerelateerde leerprogramma’s
Geef een antwoord