Keywords
CADASIL – beroerte – MRI
Introductie
Cerebrale Autosomaal Dominante Arteriopathie met Subcorticale Infarcten en Leucoencephalopathie (CADASIL) is een erfelijke aandoening van kleine arteriën veroorzaakt door verschillende pathogenetische mutaties van het NOTCH-3 gen. Zij wordt gekenmerkt door de associatie van migraine met aura, psychiatrische symptomen, recurrente ischemische gebeurtenissen op jonge leeftijd en cognitieve stoornissen. Dit en de typische radiologische bevindingen is wat ons gewoonlijk helpt om de ziekte te vermoeden. De ziekte wordt gewoonlijk beschouwd als een ziekte van jonge volwassenen en volwassenen van middelbare leeftijd, maar gevallen bij ouderen kunnen ondergediagnosticeerd zijn. Wij melden het geval van een man die aan het eind van zijn zeventigste werd gediagnosticeerd met CADASIL dankzij de eerdere diagnose van zijn dochter.
Cases Reports
Case 1
De dochter van onze patiënt was 50 jaar oud toen zij vanuit de polikliniek neurologie naar ons ziekenhuis werd gestuurd voor nader onderzoek, vanwege de radiologische bevindingen op haar MRI-scan van de hersenen, die bestonden uit witte stof veranderingen in beide uitwendige kapsels, bilaterale periventriculaire gebieden en de linker temporale kwab.
Zij bezocht voornoemde kliniek omdat zij al 30 jaar leed aan migraine met visuele aura, waarbij sommige episoden leken op een visuele aura zonder hoofdpijn. Ze had geen andere symptomen. Ze was allergisch voor fosfomycine en had een tonsillectomie ondergaan toen ze een kind was. Ze had geen andere medische voorgeschiedenis. Haar familiegeschiedenis was opmerkelijk: haar moeder had migraine en lichte dementie en haar vader had een beroerte gehad op de leeftijd van 75 jaar; haar grootvader van vaderskant, oom en tante hadden beroertes gehad, en bij de oom was de ziekte van Alzheimer vastgesteld, een neef van vaderskant had elders de diagnose “ANA+ vasculitis” gekregen en bij een andere neef van vaderskant was multiple sclerose vastgesteld. Zij had twee gezonde zonen. Het lichamelijk onderzoek, met inbegrip van een nauwgezet neurologisch onderzoek, was volledig normaal. De herhaalde MRI-scan van de hersenen toonde meervoudige hyperintense laesies in de witte stof van de protuberans posterior, periventriculaire en subcorticale gebieden, met inbegrip van de anterieure temporale kwabben, vooral de linker, beide centrum semiovale, interne en externe capsules, zonder tekenen van recente of vroegere microbloedingen (figuur 1). Alle andere onderzoeken, waaronder hemogram, glucemie, lever- en nierfunctie, erytrocytenbezinkingssnelheid, serum schildklierhormonen, hypercoagulabiliteitsonderzoek, vasculitisonderzoek, EKG, röntgenfoto van de borstkas, syfilis- en HIV-serologieën, en ultrasonografie van de supraaortale stam met Doppler, waren normaal, met uitzondering van een cholesterolemie van 220 mg/dl met een LDL-cholesterol van 152 mg/dl. De huidbiopsie was ook normaal. Een Arg169Cys mutatie (cytosine naar thymine substitutie in het 505 codon) werd gevonden in het vierde exon van het NOTCH 3 gen, waarvan bekend is dat het pathogeen is, dus werd bij haar de diagnose CADASIL gesteld. Met deze diagnose werden beide ouders in onze kliniek geëvalueerd.
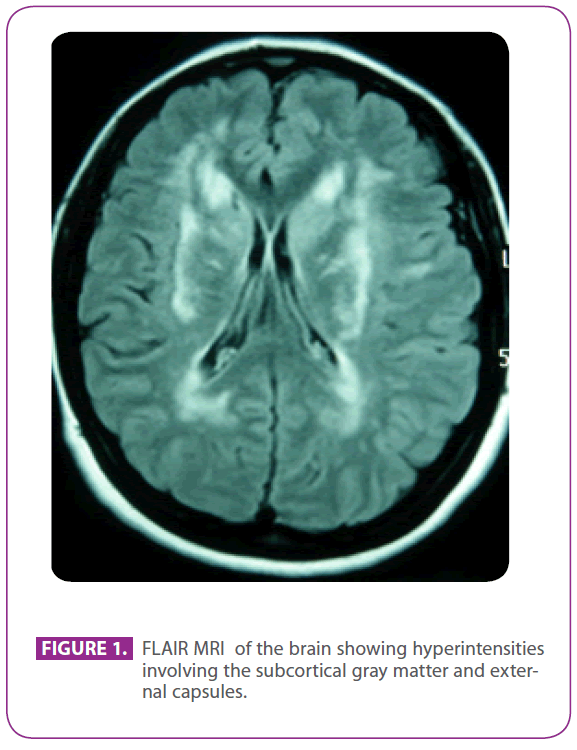
Figuur 1: FLAIR MRI van de hersenen toont hyperintensiteiten waarbij de subcorticale grijze stof en externe capsules betrokken zijn.
Geval 2
Haar moeder was 78 jaar oud. Zij had een lange voorgeschiedenis van migraine zonder aura en had in de laatste twee jaar een lichte dementie ontwikkeld met symmetrisch parkinsonisme, schommelingen en REM-slaapgedragsstoornis, suggestief voor dementie met Lewy lichaampjes. Hersen MRI sloot relevante witte stof ziekte uit.
Haar vader was een 79-jarige man met verschillende vasculaire risicofactoren: diabetes mellitus type 2, dyslipidemie, en 50 jaar gerookt, met een gecumuleerde index van 15 pack-jaren, hoewel hij 3 jaar geleden was gestopt. Hij had ischemische hartziekte met een postero-inferior myocardinfarct in 1991. In de laatste 8 jaar had hij drie voorbijgaande ischemische ongevallen en een lacunaire beroerte gehad die overeenkwamen met verschillende arteriële gebieden, met progressieve loopstoornissen, en in de laatste 6 maanden was hij een beetje teruggetrokken en apathisch geworden. Hij had geen voorgeschiedenis van migraine. Hij gebruikte metformine, clopidogrel, atenolol en atorvastatine. Bij lichamelijk onderzoek was hij bij bewustzijn en georiënteerd, maar een beetje onoplettend, de taal en het afstands- en recente geheugen waren normaal, hij vertoonde ideomotorische apraxie, veranderde gelijkenis- en zeggingsinterpretatie, zonder frontale vrijlatingsreflexen. Hij toonde ook globale hyperreflexie met bilaterale flexor plantar reflexen, en een gang met korte passen en verminderde armbewegingen. Een CT-scan die twee jaar eerder werd gemaakt, na een van zijn voorbijgaande ischemische aanvallen, toonde uitgebreide witte stof ziekte, vooral prominent in het externe kapsel en de temporale kwabben (figuur 2).
Samenvattend had de patiënt recidiverende ischemische beroertes, milde subcorticale cognitieve stoornissen en leukoencephalopathie, zeer verdacht voor CADASIL gezien de diagnose van zijn dochter. Er werd een genetische test uitgevoerd, die dezelfde NOTCH 3 mutatie aantoonde als bij haar dochter en de diagnose bevestigde.
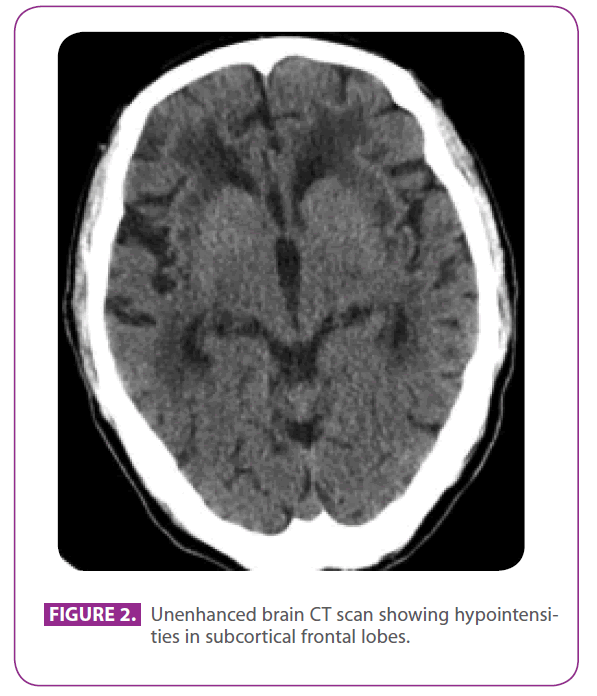
Figuur 2: Unenhanced brain CT scan showing hypointensities in subcortical frontal lobes.
Discussie
CADASIL is de meest voorkomende erfelijke aandoening met kleine bloedvaten. Zij kan echter ook sporadisch voorkomen, aangezien de novo mutaties zijn beschreven. De ziekte wordt veroorzaakt door verschillende pathogene mutaties in het NOTCH-3 gen, dat gelegen is op chromosoom 19, locus 19p13.2-p13.1, en bestaat uit 33 exonen die coderen voor een 2321 aminozuren tellend eiwit (1). Dit eiwit is een single-pass transmembraan celoppervlakte receptor die tot expressie komt in systemische arteriële gladde spiercellen, met een extracellulair regulator domein en een intracellulair transductor domein. Er zijn tot op heden meer dan 190 mutaties gerapporteerd die tot CADASIL kunnen leiden, en al deze mutaties komen voor in de exonen 2 tot en met 24 van het NOTCH 3-gen, die coderen voor de 34 epidermale groeifactorachtige herhalingen van het extracellulaire gedeelte van NOTCH 3. Daarom heeft de screening van deze 23 exonen een gevoeligheid van 100% en een vrijwel gelijke specificiteit (2). Van deze mutaties zijn er meer dan 180 missense mutaties, ten minste 6 deleties, één insertie, één frameshift en 2 duplicaties. De meeste pathogene NOTCH3 mutaties treden op in exonen 3 en 4 (3).
Alle mutaties resulteren in een toevoeging of verlies van een cysteïneresidu in een EGF-achtige herhaling, en daardoor een oneven aantal cysteïneresiduen dat de vorming van abnormale disulfidebruggen tot gevolg heeft. De mutant NOTCH3 veroorzaakt degeneratie van vasculaire gladde cellen in kleine slagaders en arteriolen en accumulatie van het abnormale eiwit in de wand van deze vaten, wat leidt tot lumenstenose (1). In de hersenen tast het de penetrerende cerebrale en leptomeningeale slagaders aan, wat het onvermogen van deze vaten om te autoreguleren en hypoperfusie van de door hen bevloeide gebieden veroorzaakt, en daardoor infarcten in de witte stof.
Het eerste symptoom van CADASIL, wanneer het zich presenteert, is meestal migraine met aura, met een gemiddelde beginleeftijd van 30 jaar. Het treedt op bij 20 tot 40% van de patiënten (4). De meeste aanvallen zijn typisch met een visuele of sensoriële aura, maar de helft van de patiënten heeft ook atypische aanvallen met een basilaire, hemiplegische of langdurige aura.
Subcorticale ischemische gebeurtenissen, voorbijgaande aanvallen of beroertes, treden op bij 60 tot 85% van de patiënten, de eerste op een gemiddelde leeftijd van 50 jaar, hoewel het al in het tweede decennium kan optreden. In de meeste gevallen zijn er geen conventionele vasculaire risicofactoren of zijn deze niet erg belangrijk. Bij twee derde van de patiënten presenteren de ischemische gebeurtenissen zich klinisch en radiologisch als lacunaire syndromen. De meeste patiënten hebben meerdere beroerten, meestal 2 tot 5, die in de loop der jaren leiden tot loopmoeilijkheden, incontinentie voor urine en ontlasting, dementie en pseudobulbar palsy (1). Cognitieve stoornissen zijn de tweede meest frequente klinische manifestatie. Het vroegste teken is gewoonlijk een verslechtering van de uitvoerende vermogens en de verwerkingssnelheid, die bij de meeste patiënten ouder dan 35 jaar aanwezig is, maar al in de eerste tien jaar van het leven kan optreden (5). Deze cognitieve stoornis is progressief en verergert gewoonlijk bij recidiverende beroerten, met toevoeging van stoornissen in instrumentele activiteiten, geheugen, taal, redeneervermogen en visuospatiële vermogens. Meer dan 70% van de patiënten is dement tegen het zesde levensdecennium. Ernstige afasie, apraxie of agnosie zijn zeldzaam bij CADASIL.
Psychiatrische stoornissen, voornamelijk stemmingsstoornissen, komen voor bij 20% van de patiënten, in het algemeen als ernstige depressieve episoden. Apathie komt voor bij 40% van de patiënten en houdt geen verband met depressie Andere minder vaak voorkomende klinische manifestaties zijn acute reversibele encefalopathie (6) (bij 10% van de patiënten), meestal optredend na migraine met aura, toevallen (bij 5 tot 10% van de patiënten), doofheid, parkinsonisme, hersenbloedingen (meestal bij patiënten met hoge bloeddruk), en myocardinfarct.
Ondanks de volledige penetrantie heeft CADASIL een belangrijke inter- en intrafamiliale klinische expressievariabiliteit. Dezelfde NOTCH-3 mutatie heeft een breed klinisch spectrum, zonder duidelijke verschillen tussen homozygote en heterozygote patiënten. In feite is er geen correlatie tussen genotype en klinisch fenotype (4). De reden van deze verschillen is niet bekend, maar enkele mogelijke fenotype modifiers van CADASIL zijn beschreven, zoals huidig roken voor risico van beroerte en leeftijd van de eerste beroerte, hoge bloeddruk voor risico van beroerte, of homocysteïne niveaus voor leeftijd van begin van migraine (3,4). Deze en andere factoren kunnen de klinische expressie van de ziekte beïnvloeden door de genexpressie te wijzigen of door andere fysiopathologische routes te beïnvloeden die tot dezelfde klinische manifestaties kunnen leiden.
Radiologische veranderingen verschijnen bij alle personen met een CADASIL-mutatie vóór de leeftijd van 35 jaar en nemen toe met de tijd. De vroegste en meest frequente kenmerken zijn hyperintense niet-beïnvloedende punctiforme gebieden in de cerebrale witte stof en subcorticale structuren op T2-gewogen en vloeistofgeattenueerde inversieherstelbeelden van MRI. Betrokkenheid van externe capsules en het voorste deel van de temporale kwabben is typerend voor deze ziekte en een aanwijzing voor de diagnose, omdat ze helpen bij de differentiaaldiagnose met andere aandoeningen zoals small-vessel disease (1).
CADASIL wordt algemeen beschouwd als een ziekte van jonge en middelbare leeftijd volwassenen, maar het aantal oudere patiënten zou ondergediagnosticeerd kunnen zijn (7,8). Onze tweede casus kan als voorbeeld dienen: een 79-jarige patiënte met vasculaire risicofactoren en recidiverende beroertes, met witte stof ziekte die door verschillende neurologen werd beschouwd als secundair aan kleine vaten ziekte. De diagnose werd pas gesteld na de kennis van de mutatie van zijn dochter. In gevallen zonder duidelijke familiegeschiedenis kan een open geest en zorgvuldige aandacht voor suggestieve radiologische bevindingen zoals de betrokkenheid van het externe kapsel of de anterieure temporale kwabben de enige aanwijzing zijn voor een juiste diagnose.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009; 8:643-53.
- Vazquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL: een case serie van 11 patiënten. Rev Neurol. 2011; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. Clinical spectrum of CADASIL and the effect of cardiovascular risk factors on phenotype: study in 200 consecutively recruited individuals. Stroke 2010; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. De invloed van genetische en cardiovasculaire risicofactoren op het CADASIL-fenotype. Brain. 2004; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Donepezil in patients with subcortical vascular cognitive impairment: a randomised double-blind trial in CADASIL. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. “CADASIL coma”: een ondergediagnosticeerde acute encephalopathie. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. Homozygotie voor een NOTCH3-mutatie bij een 65-jarige CADASIL-patiënt met milde symptomen: een familieverslag. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. The remarkably variable expressivity of CADASIL: report of a minimally symptomatic man at an advanced age. J Neurol. 2009;256:1026-7
Geef een antwoord