Resultaten
Om de maximale emissiegolflengte te vinden om de fluorescentie-intensiteit van AMC na trypsinesplitsing te controleren, werden de excitatie- en emissiespectra gemeten en deze worden getoond in figuur 1. De maximale emissiegolflengte bleek 440 nm te van het AMC
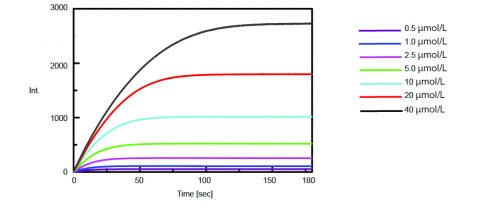
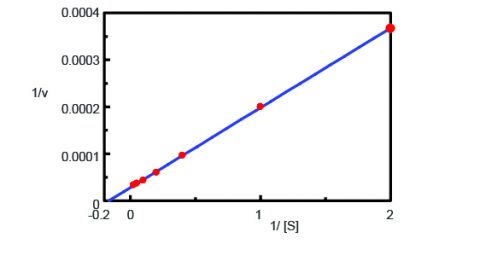
Om de gemeten fluorescentie-intensiteit van de enzymafgifte te standaardiseren naar de concentratie van geïsoleerd AMC, werd een titratie uitgevoerd en de fluorescentie gemeten. Er werden 0,5 ml van een 50 µ van een L AMC-oplossing toegevoegd aan een enzymoplossing van 2,5 ml en de begin- en eindconcentraties van geïsoleogd AMC zijn samengevat in tabel 1. Tabel 1. Geïsoleerde AMC-concentraties voor en na standaardisatie van de fluorescentie-intensiteit. De kinetiek van de trypsineactiviteit werd vervolgens verkregen door het meten van de fluorescentie-intensiteit van geïsoleerd AMC bij splitsing van trypsine uit het substraat. Figuur 2 toont de tijdsverloopmeting nadat 0,5 mL van variërende concentraties van de Boc-Gln-Ala-Arg-MCA-substraatoplossing waren toegevoegd aan 2,5 mL van de enzymoplossing. Met behulp van het programma Kinetics Analysis werd een Lineweaver-Burk-grafiek (figuur 3) uitgezet op basis van de fluorescentietijdsverloopmetingen in figuur 2. De Lineweaver-Burk-plot levert kinetische parameters voor enzymen op, zoals de maximale reactiesnelheid, Vmax, en de Michaelis-Menten-constante, Km. Vmax beschrijft de reactiesnelheid wanneer het enzym verzadigd is met substraat, terwijl Km de hoeveelheid substraat aangeeft die nodig is om de maximale reactiesnelheid te bereiken. Vmax was 35,270 nmol/L-min-1 en Km was 5,99. De vergelijking van de lijn was 1/v = 0,000270 – 1/ + 0,0000284.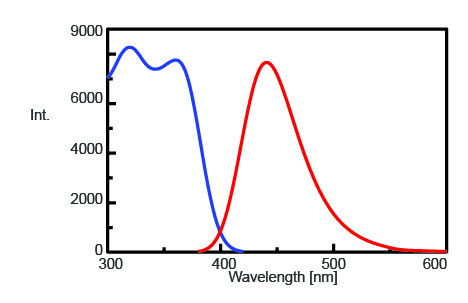
Initiële concentratie
3
6
15
60
120
240
Eindconcentratie
0.5
1
2,5
5
10
20
40
Geef een antwoord