プロテオペディアより
proteopedia linkproteopedia link
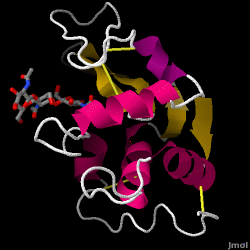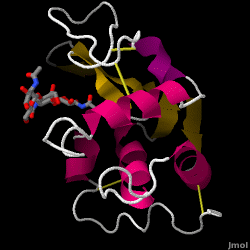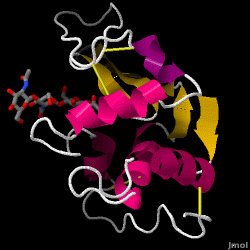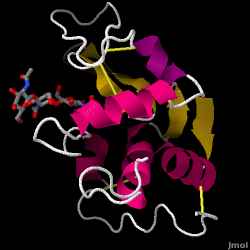
リゾチーム(別名ムラミダーゼ)は、涙、唾液、母乳に豊富に含まれる強力な酵素であります。 ヒトでは、LYZ遺伝子にコードされています。
はじめに
リゾチームは、細菌や真菌に対する非特異的な防御機構として作用します。 自然免疫系の構成要素であり、乳児の下痢を防ぐために重要な役割を担っている。 通常、細菌感染から身を守る目的で、多くの種類の細胞壁の多糖類構造を分解する能力で知られる酵素である。 今回取り上げる鶏卵白(HEW)リゾチームの構造を右図に示す。 鶏卵白の抗菌活性は、1909年にLaschtschenkoによって初めて報告された。 ペニシリンの発見者と同じアレキサンダー・フレミングによって特徴づけられ、「リゾチーム」と命名された。 酵素活性の発見は偶然であった。無関係の実験中に、細菌培養の入ったシャーレに鼻汁が誤って混入し、その培養物がまだ知られていない酵素反応の結果を示したのである。 この未知の反応の観察から、この反応の成分に関する研究が進み、新たに発見された “リゾチーム “の同定に至った。 1965年、David C. Phillipsらは、リゾチームの3次元構造を2Åの分解能で決定した。 フィリップスは、X線結晶構造解析によって酵素の構造を解明するという、それまで誰もなし得なかった偉業を成し遂げたのである。 フィリップスの研究はまた、その作用メカニズムについて、構造に基づく仮説を導き出した。 個々の六糖結合単位はA-Fと呼ばれ、NAM₄-β-O-NAG₅のグリコシド結合切断優先度はD-Eユニットのグリコシド結合cl
リゾチームは1.の加水分解を触媒して細菌細胞壁を傷害することが知られ、この触媒作用により細菌は細胞壁を傷害する。ペプチドグリカン中のN-アセチルムラミン酸(NAM)とN-アセチル-D-グルコサミン(NAG)残基間、およびキトデキストリン中のN-アセチル-D-グルコサミン残基間の4β-結合を形成する。 このようにして、リゾチームは細菌と真菌の両方の細胞壁を効率よく溶解することができる。 リゾチームがこの建築テーマで切断する場所は、NAMのC1炭素とNAGのC4炭素をつなぐβ(1-4)グリコシド結合である。
この切断型が好む特定の基質は、(NAG-NAM)₃六糖であり、この基質の中に、NAM₄-β-O-NAG₅という切断対象のグリコシド結合が存在する。 個々の六糖結合単位をA-Fとし、NAM₄-β-O-NAG₅のグリコシド結合切断の優先度はD-E単位のグリコシド結合切断の優先度に対応している。 リゾチームが得られる生物によって、グリコシド結合の加水分解はアノマー炭素の配置を保持したまま(ヘン卵白)、あるいは反転したまま(ガチョウ、ファージT4)進行する。
リゾチームは長い(NAG-NAM)あるいは(NAG)ポリマーに効率的に作用する。 鎖長が6モノマーより小さくなると、触媒率は大幅に低下する。実際、3糖は非生産的な登録で活性部位に結合し、競合的阻害剤として働く。
Hen egg white lysozyme (PDB code 1hew)
Mechanism
Hen egg white lysozymeによるグリコシド結合の加水分解は配置を保持したまま進行している。 1953年、Koshlandは一般に配置の保持は二重置換機構を意味し(一方、配置の反転は一重置換を意味する)、そのような機構を示唆した。 何十年もの間、2つの機構仮説(Phillips:オキソカルベニウム中間体を伴う解離性機構、Koshland:共有結合酵素複合体を中間体とする2段階の会合性機構)が競合していたが、2001年のデータで共有結合中間体の存在に傾斜していることが判明した。 基質複合体構造がないことは、同じ構造の酵素ファミリーの中に2つの異なるメカニズム(配置の保持と反転)が存在することと同様に、可能性のあるメカニズムを区別することを困難にしたことは確かである(例. 3976>
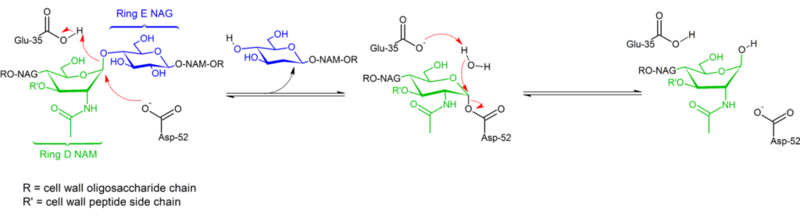
Lysozyme はグリコシド(それゆえリゾチームはグリコシラーゼとして分類されている)を加水分解し、それはアセタールをヘミアセタールに変換することに相当する。 この反応は上図に示すように2段階で進行する。 第一段階では、Asp52が求核剤として働き、糖の一部が脱離基となる。 第二段階では、水が求核剤として働き、Asp52が脱離基として働く。 どちらの段階でも、アノマー炭素の配置が反転し、全体として配置が保持される。 Glu 35は、第一段階では酸として働き(糖のグリコシド結合をプロトン化して親電子性を高める)、第二段階では塩基として働く(水を脱プロトン化して求核性を高める)。 図では配置の反転を強調するために、いくつかの糖がボートコンフォメーションになっているが、これらは実験的には観察されず、むしろチェアコンフォメーションで見られる。 分子生物学では、プラスミドDNAを抽出・分離するためのアルカリ分解法において、リゾチームがよく利用されています。 また、医薬品の分野では、グラム陽性菌の破壊に広く用いられ、細菌感染に対抗するための既存の免疫防御をサポートするために使用することができる。 特に乳幼児の細菌性疾患の予防に重要な酵素である。 また、リゾチームはその抗菌性から、食品の腐敗防止に役立つため、食品産業にも使用することができます。
参照
- Lysozyme 3D structures
- 保持型グリコシドヒドロラーゼ
- Molecular Playground/Lysozyme
- User:Judy Voet/Lysozyme
- Lysozyme (Arabic)
- Lysozyme (hebrew)
- Ragland SA, Criss AK. 細菌の殺傷から免疫調節まで。 リゾチームの機能に関する最近の洞察。 PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:<1612><1783><332> Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. を嚆矢とし,爾後,漸次,漸次,漸次,漸次,漸次,漸次,漸次,漸次,漸次,漸次,漸次,漸次,漸次,漸次…………………. また,”li “は “li “であり,”li “は “li “である。 鶏卵白リゾチームの構造。 2オングストローム分解能での3次元フーリエ合成。 Nature. 1965年5月22日;206(986):757-61. PMID:5891407
- Bugg, T. 1997. 酵素と補酵素化学への入門. Blackwell Science Ltd., Oxford
- Earliest Solutions for Macromolecular Crystal Structures.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. 鶏卵白リゾチームの活性に関する結晶学的研究. 1967年4月18日;167(1009):378-88。 PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Image from: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. タンパク質の初期リボン描画。 Nat Struct Biol. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. 鶏卵白リゾチームの構造。 2オングストローム分解能での3次元フーリエ合成。 Nature. 1965年5月22日;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. リゾチーム阻害剤複合体の結晶構造を6オングストローム分解能のX線分析により決定した。 Nature. 1965 May 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. このような場合、「醗酵室」での醗酵は、醗酵の進行に伴い、醗酵の進行に伴い、「醗酵室」での醗酵が進行する。 Nature. 2001年8月23日;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers and Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland,D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Proteopedia Page Contributors and Editors (what is this?)?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
より取得したものです。
コメントを残す