Introduction
粘土/高分子ナノコンポジットの設計と製造は、科学と工学両方のコミュニティから高い関心を集めている(Cheng et al.,2017)。 多種多様な粘土/ポリマーナノコンポジットが開発され、広く応用されている(Gogoi and Raidongia, 2017)。 粘土を予めインターカレーションし、その後、粘土鉱物層にポリマーを組み込むことは、粘土/ポリマーナノコンポジットの調製のために広く採用されているアプローチである(Liら、2009;Zareら、2017)。 無機粘土層内にインターカレートされている間、有機ポリマー鎖は自然にその構造的移動度を低下させ、それらのいくつかは層状構造内で高度に組織化されたコンフォメーションをとる。
自然界において、カオリナイト(Kaol)は1:1二面体アルミニウムシリケート層状構造(Brindley and Robinson, 1945)の粘土鉱物の一種である。 カオールの層は水素結合、双極子-双極子相互作用、ファンデルワールス力によって結合されている(Brindley et al.) しかし、尿素(Makó et al., 2009)、ジメチルスルホキシド(Costanzo and Giesse, 1986)、ホルムアミド(Frost et al., 2000a)、ヒドラジン(Cruz and Franco, 2000)、酢酸カリウム(Frost et al., 2000b)など限られた高極性の有機種だけがKaolのギャラリーへのインターカレーションに成功しました。 Kaol層への小分子のインターカレーションは基底間隔の増加を引き起こし、事前にインターカレーションされた小分子の変位によって、その後の大型で非反応性の種を挿入するための予備的拡大ステップとして使用できる(Chengら、2015年)。 例えば、これまでの報告に基づいて、カオル/メタノールインターカレーション化合物は、エチレングリコール(Hirsemannら、2011)、ヘキシルアミン(Matusikら、2012)、n-アルキルアミン(GardolinskiとLagaly、2005)、および第4級アンモニウム塩(Chengら、2016)とさらにインターカレーション反応するための有効な中間体とすることができます。 さらに、ゲスト分子の大部分は層間に挿入されにくく、その理由の1つは強い水素結合であり、もう1つはKaol構造中に交換可能なイオンが存在しないことである。
粘土/ポリマーナノコンポジットは近年よく開発されているが、潜在的応用のための新しい粘土/有機ナノコンポジット合成は依然として大きな課題を提起する(KotalおよびBhowmick、2015)。 この問題を解決するためには、カオリナイトのインターカレーションのナノスケールでのプロセスを解明し、現代の技術と分析ツールで分解メカニズムを徹底的に調べることが、まさに急務である。 粘土/高分子インターカレーション化合物の熱分析と動力学計算は、分解プロセスの特徴づけに役立ち、インターカレーション反応を制御するための科学的根拠を与えることができる(Zhangら、2015)。 分解反応速度論過程の活性化エネルギー、前指数、反応次数、速度定数などの動力学パラメータを粘土/高分子サーモグラムのデータを用いて評価した。 本研究では、カオールと各種アルキルアミンのインターカレーションを検討した。
Experimental
Materials
本研究で用いたカオルは中国張家口で採取されたものである。 主な鉱物組成は整然としたカオリナイト(質量比95%)である。 インターカレーション前に325メッシュのふるいにかける(粒径<44μm)。 アルキルアミンヘキシルアミン(HA、99%)、ドデシルアミン(DA、Chemically Pure)、およびオクタデシルアミン(OA、Chemically Pure)は、中国のNanjing Shuguang Chemical Companyから購入した。 ジメチルスルホキシド(DMSO、分析試薬)、メタノール(MeOH、分析試薬)、およびトルエン(99%)は、中国のXilong Chemical Companyから受け取り、さらに精製せずに受け取ったまま使用された。 HA、DA、およびOAの化学式と構造式を表1に示す。

Table 1. HA、DA、OAの化学式と構造式。
インターカレーション化合物の合成
まず、Kaol/DMSOインターカレーション化合物を、20.0 g Kaolを36.0 g DMSOと4.0 g水の混合物に分散させ、準備した。 この混合物を水浴中で95℃、2時間撹拌した後、エタノールを用いて遠心分離し、懸濁液を分離した。 次に、Kaol/DMSOインターカレーション化合物を前駆体として用い、さらにMeOHと反応させた。 MeOHをプレインターカレーションしたKaolに加え、反応混合物を10日間攪拌し、毎日MeOHを同量の新しいMeOHに交換した。 混合物中の沈殿物を遠心分離し、60℃のオーブンで12時間乾燥し、Kaol/MeOHインターカレーション化合物を得た。 最後に、2 gのKaol/MeOHインターカレーション化合物を、30.0 mLのHA、DA、またはOAメタノール溶液(1 mol/L)とそれぞれ周囲温度で攪拌しながら混合した。 24時間反応させた後、分散液を遠心分離した。沈殿物をトルエンで3回洗浄し、過剰なHA、DA、またはOAを除去した。 室温で12時間乾燥させ、メノウ乳鉢で粉末にした(Komori et al., 1999)。 得られた化合物はカオルピ/HA(pi as pre-intercalated)、カオルピ/DA、カオルピ/OAと表示した。
Characterization
XRDパターンはRigaku D/max 2500PC X-ray diffractionometerでCu Kα(λ = 1.54178Å) radiationを用いて40 kV、150 mAで記録された。 ランダムに配向した試料サンプルを2° min-1の速度で1〜20°の2θの範囲で走査した。 FTIRスペクトルはThermo Fisher Nicolet 6700 spectrophotometerを用いて4,000~400cm-1の範囲で記録した。 TG-DSC分析は,窒素雰囲気下でMettler-Toledo TG-DSC I/1600 HT同時熱分析装置を用いて実施した。 試料20ミリグラムをアルミナるつぼに入れ、4、6、8、10℃分-1の一連の加熱速度で30から1100℃まで加熱した。
結果と考察
XRD Characterization
原始カオルおよびそのインターカレーション化合物のXRDパターンは図1に示すとおりであった。 原石のパターンは0.71 nmの基底間隔を持つ整然とした層状構造を示しています。 この値は、標準的なICDD参照パターン14-0164とよく一致する。 DMSOで処理すると、1.14 nmに新しい基底反射ピークが現れ、DMSOがKaol中間膜にうまく挿入されたことが示された。 Kaol/DMSOインターカレーション化合物をMeOHで処理した後、Kaol/DMSOインターカレーション化合物の1.14 nm (001) 反射特性は0.86 nmにシフトしていることがわかった。 また、Matusikら(2012)により、Kaol/DMSO/MeOH化合物を110℃で乾燥させると、d = 1.12 nmの反射が消失し、0.95 nmに最大値を持つ幅広い反射が観察されたことが報告されている。 CHNS分析に基づいて計算したKaol/DMSOインターカレーション化合物の化学式Al2Si2O5(OH)3.20(OCH3)0.80に基づいて、内表面のOH基の約1/3がメトキシ基で置換されており、この観察もKaol/MeOHインターカレーション化合物が生成したことを示している(Tunney and Detellier, 1996; Cheng et al, 2015)。 XRDパターンからも、HA、DA、OAとインターカレーションしたKaol/MeOH化合物はc軸に沿って構造を拡大し、それぞれ2.86、4.08、5.66 nmという大きな層間距離をもたらしていることがわかる。 HA、DA、OAの分子鎖の長さはそれぞれ1.56、2.51、3.65 nmである(McNultyら、2011、2014)。 全体として、Kaol/アルキルアミンインターカレーション化合物の層間距離はアルキルアミンのアルキル鎖長とともに増加したが、アルキルアミン分子はKaol表面に垂直な単層または二層構造ではない。
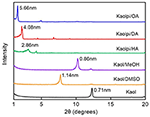
FIGURE 1. Kaol、Kaol/DMSO、Kaol/MeOH、Kaolpi/HA、Kaolpi/DA、およびKaolpi/OAのXRDパターン
FTIR Spectra
インターカレーション化合物の特性評価に広く用いられてきた(Ledoux and White、1964; Frostら、2000c;Chengら、2012)。 オリジナルのカオル、カオルピ/HA、カオルピ/DA、およびカオルピ/OAインターカレーション化合物のFTIRスペクトルを図2に示す。 432、470、541cm-1(図2B)の特徴的なバンドは、Si-O、Si-O-Si、Al-O-Siの変形モードに属している。 1,009, 1,031, 1,114 cm-1 (図2C) の他のバンドは、Kaolの層中のSi-O-Siの伸縮振動に割り当てられている。 Kaolとそのインターカレーション化合物のスペクトルを比較すると、バンドの位置に明らかな変化はなく、この伸縮振動バンドはインターカレーション分子の影響を受けていないことがわかる。
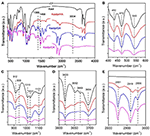
Figure 2.図2. Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OAの赤外スペクトル
912cm-1と938cm-1のバンド(図2C)は内水酸基と内表水酸化基のOH変形に属している。 元のKaolのスペクトルには3,694, 3,669, 3,652, 3,620 cm-1(図2)に4つの明らかな水酸基伸縮バンドがあり,3,694, 3,669, 3,652 cm-1のバンドは内側表面水酸基に起因し,3,620 cm-1のものは内側水酸基に起因する(Farmer,1964 ; Ledoux and White,1964 ; Giese and Datta, 1973). アルキルアミン分子がインターカレーションされると、隣接する原子との相互作用が変化するため、いくつかのバンドが弱くなった。 3,697cm-1へのシフトと3,694cm-1のバンドの強度の低下は、Kaolの多数の水酸基が参加してアルキルアミン分子のアミン基と水素結合を形成したことを示している(Caglar、2012;Caglarら、2013;Zhangら、2015)<9512><1178>層間アルキルアミン分子の存在はFTIRスペクトル上で新しいピークによって検出されているが、それらは図2A,Eに示すように、アルキルアミン分子間の相互作用を示すものだった。 インターカレーション化合物については、1,388および1,468cm-1のバンドなどのいくつかの明らかな特徴的なピークは、それぞれ-CH3および-CH2のC-H曲げモードに属している。 3,334cm-1の新しい振動バンドは、N-H伸縮振動の伸縮モードに起因することが確認された(Griffiths and De Haseth, 2007; Zhang et al., 2018)。 2,956cm-1に新たな振動バンドが観測され、通常、末端メチル基のC-H非対称伸縮バンドに帰属した(Cheng et al.、2016)。 2,919および2,851cm-1の2つの振動バンドは、通常、-(CH2)n-の対称および非対称伸縮振動に割り当てられる(Venkataraman and Vasudevan,2001)。 バンドの強度が徐々に増加するのは、より多くのアルキルアミン炭素原子がKaol中間膜に挿入されたことを意味する。 さらに、アルキルアミンの揮発性は炭素鎖の増加とともに減少するので、対応するKaolインターカレーション化合物の安定性はアルキルアミンの分子量が大きくなると徐々に増加する(Wang et al. Lagaly(1981)によると、モンモリロナイト-四級アンモニウム塩インターカレーション化合物の構造モデルは3つに分類できる。 (a)単層:短鎖アルキルアミンイオン、(b)二層:長鎖四級アンモニウムイオン、(c)三層:高帯電粘土鉱物中のキンクしたアルキル鎖。 BenekeとLagaly(1982)はさらに、XRDに基づいてインターカレーションされたアルキルアミン分子の異なる構造を提案し、その概要は次の通りである。 (a) 層間空間のアルキル鎖が(001)結晶面に対して傾いている、(b) アルキル鎖が二層構造で配列している。 Brindley and Moll (1965) は、層間分子が単層では珪酸塩シートに対して傾いているのに対し、(001) 結晶面に対して約 65°の角度を持つことを述べている。 もし、相互作用する分子が活性な水酸基によってすべての珪酸塩表面に一様に付着しているならば、いくらかの縦方向の変位を伴う対の「端から端まで」の組織化が示唆される。
アルキル分子はKaolの層間空間に交換可能なイオンがないため、元のKaol層に直接インターカレートすることは困難であった。 アルキルアミン分子がKaolの層間に挿入される際には、有効な前駆体が必要である。 塩化アルキルトリメチルアンモニウム鎖はKaolの層間に傾斜した二重層を形成し、計算後の傾斜角は〜36°であることが報告されている(Kuroda et al.、2011)。 Yuanら(2013)は、Kaolの層間における4級アンモニウム塩分子の構造配置が傾いた二重層を形成し、その傾き角は〜38.4°であることを指摘している。 Gardolinski and Lagaly (2005)は、中間層のアルキル鎖は二層によって完全に引き伸ばされ、Kaol表面に対して垂直に配向していると提案した。 したがって、HA、DA、OA分子の鎖長を分析すると、インターカレーション後の基底部の間隔は、アルキル鎖が垂直方向および二層で入り込むには十分ではないという結論が導き出される。 XRDの結果をさらに分析すると、HA、DA、OAのアルキル鎖は二層膜のカオル表面に対して傾いており、アルキル鎖の傾斜角はそれぞれ約39.9, 39.9, 41.1°であることがわかる。 また、Kaolの内表面水酸基とアルキルアミン分子のアミン基との間の水酸基結合により、Kaol/アルキルアミンインターカレーション化合物の最も可能性の高い構造モデルを図3に示す。
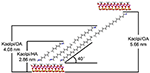
Figure 3. カオリナイト/アルキルアミン層間化合物の最も可能性の高い構造モデル。
熱分析
Kaolとそのインターカレーション化合物のTG-DSC分析結果を図4に示します。 Kaolの主な質量減少は400〜600℃の間のもので、525℃で最大の損失率は結晶格子の脱水素化により水が失われ、メタカオリナイトが形成されたことに起因する(Toussaint et al.1963; Criado et al.1984; Sperinck et al.2011). この損失は全質量の約12.7%に相当し、理論的な基準値(13.9%)に極めて近い値である。 オリジナルのKaolのTG-DSC曲線を比較すると、Kaolpi/HA、Kaolpi/DA、Kaolpi/OAインターカレーション化合物では、主に2つの質量減少ステップが観測された。 1つ目は150~350℃の間で起こり、これはインターカレーションされたアルキルアミン分子の分解によるものである(Yuan et al.、2013)。 2つ目は約500℃で発生し、これはインターカレーションしたKaolの脱水素に起因する。 カオルピ/OAについては、いくつかのOAがシリケートの層間空間にインターカレーションして安定なインターカレーションを形成しており、これはXRDパターンによって証明することができる。 一部の分子は、長鎖またはナノスクロールのクランプのために互いの中で絡み合い、完全に除去することができない(Li et al, 2015; Liu et al, 2016)。 220℃では、明確な質量損失はコーティングされたまたは結合していないOAの分解に起因し、330℃での質量損失はインターカレートされたOAの分解に起因する。 996℃の発熱ピークはKaolの再結晶によるものであった。 Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
元のKaolとKaol/アルキルアミンインターカレーション化合物のTG-DSC曲線を比較すると、観察できることがある。 (a) Kaolpi/OAと他の2つのインターカレーション化合物(Kaolpi/HA, Kaolpi/DA)の間の質量損失に大きな差があるのと同様に、異なる質量損失ステップを持っています。 Kaolpi/HAとKaolpi/DAの分解による質量損失は約20%であったが、Kaolpi/OAでは2つの質量損失の合計量は約50%であった。 これは、HAやDAに比べて、より多くのOAがシリケート層間空間にインターカレートされたことに起因すると考えられる(Wang et al.) (b)インターカレーション化合物の脱水素化温度は、元のKaolのそれよりも約20℃低かった。 これは、インターカレーション分子が層間間隔を拡大し、Kaol層間の水素結合を弱め、Kaol表面からより容易に脱水素化をもたらすためである。 そのため、インターカレーション後のKaolの結晶性は急激に低下し、それはXRDとIR(800cm-1以下)で確認することができる。 この結果は、脱水素化の温度がKaolの結晶化度によって決定されるという他のいくつかの報告(Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012)と一致する。
分解反応速度論
Kaol/アルキルアミン インターカール化合物の分解速度を熱重量分析法により検討した。 分解過程の動力学パラメータ(活性化エネルギーEと前指数A)はKAS法と小澤法(Kissinger, 1957; Škvára and Šesták, 1975)を基礎として算出した。 Kaol/アルキルアミン層間化合物の熱劣化機構をSatava積分法(Xie et al., 2001; Gao et al., 2005; Zhang et al, 2015)。
反応理論によると、非等温分解速度式は通常次のように表される:
ここでαは時間tにおけるB(s)の変換率の程度、f(α)は反応機構関数、kは反応速度定数である。 kは次式に従う:
試料の温度を一定の加熱速度(β=dT/dt)で制御すると、反応速度は次のように定義することができる。
変数を分離した後、式(4)を積分または微分関数で並べ替えると、KAS式(5)、小沢式(6)は、下記のように計算することができる。
ここで、G(α)は変換の積分関数を表す。 積分近似のため、ある偏差を避けるために、Eを計算するのに反復法が使われた。 9512>
ln βh(x)=ln ARG(α)R – 1.E (7)
ln βh(x)=ln 0.00484AEG(α)R – 1.E (7403)0516ERT (8)
x=E/RTとすると、h(x)、H(x)の定義は次のようになる:
H(x)=exp(-x)h(x)/x20.00484exp(-1.0516x) (10)
反復は次の3ステップである:
(a) h(x) = 1 または H(x) = 1として、1/T に対する線形関係 lnβ/T2 と lnβ の傾きに応じて最小二乗法により E0 を計算する。
(c) E0をE1に置き換え、Ei-Ei-1 < 0. 1 kJ mol-1になるまで手順(b)を繰り返す。 Eiは分解反応の活性化エネルギーの正確な値である。
Kaol/アルキルアミンインターカレーション化合物のE値をKAS法、小澤法、反復法により計算した(表2)。 KAS法による計算結果は反復法による計算結果に近かったが、小沢反復法による計算結果は他との乖離が大きかった。 したがって,反復法の平均Eは,KAS法や小澤法よりも改善されていることから,分解反応の活性化エネルギーとみなすことができる。 Kaolpi/HA, Kaolpi/DA, Kaolpi/OA の平均 E は 104.44, 130.80, 154.59 kJ mol-1 であった。 カオルピ/アルキルアミン化合物の平均Eはアルキル鎖長に正の相関があることがわかる。 その理由の一つは、アルキル鎖が長くなるにつれて揮発性が弱くなるためである。 もう一つの理由は、カオルピ/OAが最も優れた秩序あるインターカレーション構造を持っており、脱インターカレーションが最も困難であるためである。 そして、これらの結果はXRDパターンによって確認することができる。
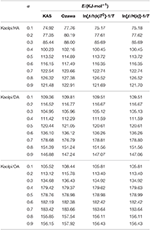
Table 2. KAS法、Ozawa法、Iteration法で計算したαの異なるKaol/アルキルアミンインターカレーション化合物のE。
分解反応機構の関数とAはSatava法で計算し、次のように記述した。315- 0.4567ERT (11)
すべての機構関数G(α)にαを代入してlgの値、線形適合lg、加熱速度に対応する1/Tを求め、最も適合度の大きい関数を最確機構関数と決定することができる。 表3に示すように、Satavaの積分式から適合度90%以上の5つの機構関数を選んだ。 この5つの関数を比較した結果、約97%の適合度を持つ9番の機構関数G(α)=2が最も可能性の高い機構関数と考えられ、その線形フィッティング曲線を図5に示した。 EとAも分解速度が正常な範囲にあることがわかる。 3種のKaol/アルキルアミン層間化合物の分解機構関数を表4に示す。

Table 3. サタバ・インテグラル法で判定した運動機構関数の選択。

Figure 5. Satava積分法で判定したNo.9関数のリニアフィッティング曲線

Table 4. Kaol/アルキルアミンインターカレーション化合物のキネティックメカニズム関数
Conclusions
XRD、FT-IR、TG-DSCを用いてKaol/アルキルアミンインターカレーション化合物の考えられる構造モデルと分解キネティクスを研究してきました。 Kaol/MeOH化合物とHA, DA, OAとのインターカレーションにより,Kaolの層間間隔がc軸方向に広がり,それぞれ2.86, 4.08, 5.66 nmに支配的な反射が現れるようになった。 さらに、インターカレーション後の基底面間隔は、アルキ鎖が垂直な単層および二層で進入するのに十分ではない。 このことから、HA, DA, OAのアルキル鎖は2層構造ではKaol表面に対して傾いており、アルキル鎖の傾斜角は〜40°であると結論した。
KAS, Ozawa, iterative methodsに基づいて、Kaol/アルキルアミンインターカレーション化合物の活性化エネルギーEを計算した結果、KASでは、アルキル鎖の活性化エネルギーは0.5%であったが、Ozawaでは、アルキル鎖が2層構造では1.5%であった。 Kaolpi/HA, Kaolpi/DA, Kaolpi/OAの平均活性化エネルギーEは104.44, 130.80, 154.59 kJ mol-1であった。 Kaol/アルキルアミン化合物の平均活性化エネルギーEは、アルキル鎖長と正の相関があった。 Kaol/アルキルアミン分解過程の最適化された機構関数は、積分関数G(α) = 2の3次元拡散と決定された。 本研究は、粘土/有機ナノコンポジットの分解機構をより深く理解するのに有利であり、さらに新しい粘土ベースの材料を合成するためのインスピレーションを与えるものである。 YZ、QhL、PXは実験を行い、論文を執筆した。
利益相反声明
著者らは、本研究が利益相反の可能性と解釈される商業的または金銭的関係がない状態で行われたことを宣言する。
謝辞
Luyiサン博士(コネチカット大学材料科学研究所化学・生体分子工学部およびポリマープログラム)は、この論文を改訂してくださいましたことを謝辞として申し上げます。 また、中国国家自然科学基金(41602171)、北京自然科学基金(8164062)、中国鉱業大学&若手研究者プロジェクト(北京)による財政支援に感謝します。 カオリナイト,ディッカイト,ナクライトにおける水酸基の配向性. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). フーリエ変換赤外分光法(Fourier Transform Infrared Spectrometry). New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., and Guggenheim, S. (1985年). カオリナイトのデヒドロキシル化。 Am. Mineral. 70, 1-2.
Google Scholar
.
コメントを残す