このチュートリアルでは、炭酸イオンのルイス構造をステップバイステップで描画します。 全価電子の概念は、CO32-のルイス構造を描くために使用されます。 CO32-のルウィス構造が完成したら、-2価の電荷と安定性があるはずです。
炭酸イオン|CO32-
炭酸イオンは-2価の電荷を持っています。 金属炭酸塩化合物は世の中によくあるものです。 として、CaCO3があげられる。
CO32- Lewis structure
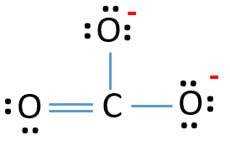
CO32-のルイス構造では、炭素原子の周りに3つのσ結合とπ結合があります。
Steps of drawing lewis structure of CO32-
CO32- lewis structureを書くには、以下のステップで詳しく説明することにします。
- 炭素原子と酸素原子の価電子殻の総数を求める
- 総電子数ペア
- 中心原子の選択
- 原子に孤立対を置く
- 孤立対から結合に変換して原子の安定性と最小電荷のチェックをする。
CO32-の共鳴構造を正しく描くには、正しいルイス構造を描くことが重要です。
CO32-の価電子数
炭素は周期表で4族に位置します。 酸素は第6族に属し、炭素の価電子数は4個です。 3431>
- 炭素原子が与える全価電子=4
CO32-イオンには酸素原子が3個ありますから、酸素原子が与える全価電子=6 *3 = 18
CO32-イオンには-2個ありますから、酸素原子が与える電子の数は6個です。 従って、価電子に寄与する電子はあと2個です。
- 全価電子=4+18+2=24
全価電子対
全価電子対=σ結合+π結合+価電子殻の孤立対
全価電子数を2で割ると、電子対が決定されます。 CO32-イオンの場合、総電子数は12個です。
CO32-イオンの中心原子
中心原子になるには、より高い価数を持つことが重要です。 炭素は4価、酸素は2価なので、炭素が中心原子になる可能性が高くなります。
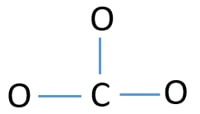
Lone pairs on atoms
- 上の図にはすでにC-O結合が3つありますね。
- まず、この9個の価電子対を外側の原子(酸素原子上)の孤立電子対としてマークします。 8進法(酸素原子は8個以上の電子を価電子帯に保持できない)により、1個の酸素原子が3個の孤立電子対をとります。
- 3個の酸素原子の場合、9個の電子対が消費されます。
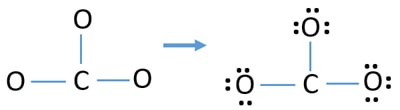
Charges on atoms
原子の電子対をマークした後は、各原子の電荷をマークする必要があります。 電荷のマークは、イオンの最適なルイス構造を決定するために使われるので、重要です。
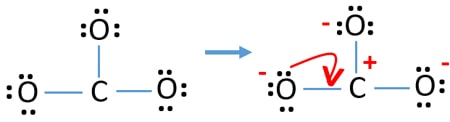
Check the stability and minimize charges on atoms by converting lone pairs to bonds
- 酸素原子は炭素原子より電気陰性度が高いため、負の電荷を持っていなければなりません。 そうでなければ、負の電荷を保持する能力は炭素原子より酸素原子の方が大きいと言えます。
- すべての原子が電荷を持っているので、描いた構造は安定したものではありません(ルイス構造はより少ない電荷で安定するはず)
- ここで、ローンペアまたはペアを結合に変換して電荷を最小化しようとするはずです。 そこで酸素原子1個の単独対をC-O結合に変換する。
- これで炭素原子と酸素原子の間に二重結合ができました(C=O結合が1つ)。
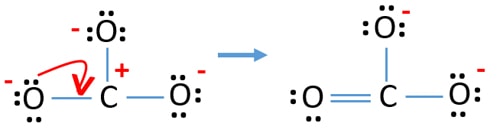
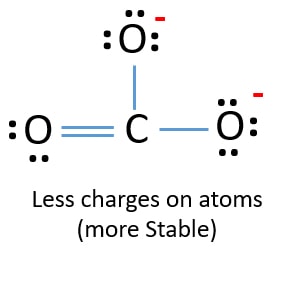
新しい構造では、原子の電荷は以前の構造より減少しています。 酸素原子1個と炭素原子の電荷はゼロになった。 また、2つの酸素原子だけが-1個の負の電荷を持っている。 これでCO32-は以前の構造より安定になったことがお分かりいただけたと思います。 したがって、この構造はCO32-イオンのlewis構造になる可能性がより高いです。
炭酸イオンのルイス構造
質問と答え
炭酸ルイス構造、重炭酸ルイス構造
炭酸イオンでは-1価の酸素原子が2個あります。 このうち1個の酸素原子はプロトン(H+イオン)を取り込んで-OH基を形成する。
関連チュートリアル
コメントを残す