13族元素には遷移後の金属があります。
遷移後の金属というのは、移行金属の次に金属である元素を指します。 メタロイドの概念と同様に、何が正確にポスト遷移金属であるかについての普遍的なコンセンサスはない。 幸いなことに、実際には、何がポスト遷移金属で何がポスト遷移金属でないかを正確に定義することは、元素をポスト遷移金属として分類することが有用である理由を理解することよりも重要である。
ポスト遷移金属の主な特徴は、古典的に金属として考えられているものに比べて、比較的電子が豊富で電気陰性であることです。 大雑把に言うと、これは相対的に低い融点(バンド構造でより多くの抗結合準位が占められる傾向があるため)、共有結合性の増加、および他の金属よりも脆い(結果として方向性のある結合のため)ことを意味します。 電子が豊富なため、柔らかい陽イオンを形成する傾向がある。
ポスト遷移金属に属する元素を分類するために、いくつかのシステムが使用されている。 主なものは以下の通り:
- d-ブロックに従う金属。 この定義では、13族以上と3行目以上の金属で、比較的軟らかい電子に富む陽イオンを形成し、その結合に大きな共有結合性を示すものだけが含まれる。 しかし、この方式を厳格に採用すると、Alは技術的にdブロックに従わないので除外され、金属類も、その多くが(n-1)d副殻を満たした比較的柔らかく電子に富む陽イオンを形成するにもかかわらず、除外される。 このシステムのもう一つの欠点は、どの元素を遷移後の金属として分類するかという問題と、どの元素を金属とメタロイドに分類するかという茨の道が絡んでしまうことである
- pブロックの金属とメタロイド この分類法は、p-ブロックの金属および金属化合物の興味深くユニークな性質と、p-ブロックを通じてのこれらの性質の連続性を強調する利点がある。 そのため、この後の章ではこの方式を使用する。 しかし、Zn、Cd、Hgのように、金属が(n-1)d10配位を持つ多くの化合物を生み出す金属を除外するという欠点がある。
- 完全に(n-1)d価電子殻を持つイオンを形成するという意味で移行元素に従う金属がAlやpブロック金属化合物と一緒になることもある。 Zn2+、Cd2+、Hg2+(およびCu+、Ag+、Au+)のような(n-1)d 10価の電子配置のイオンを形成するので、この定義にはZn、Cd、Hg(および時にはCu、Ag、Au)が加わっています。 本章ではpブロックの元素のみを考えるので、本章の目的のためにこのシステムはシステム2と機能的に同一である。
どのような分類方法を使うにしても、元素をポスト遷移金属に分類することは、ポスト遷移金属と他の金属の違いを強調する方法としてよりも、一連の元素の化学特性の類似性を強調する方法として考えたほうが役に立つことが多い。 ソフト陽イオンや共有結合でつながった化合物を形成するのは、ポスト遷移金属だけではありません。 前節で明らかにしたように、アルカリ金属でさえ、適切な状況下ではアニオンを形成し、金属の多くの化合物は、イオン的相互作用よりも共有結合性という言葉で説明する方が適切である。 このことは、前節で取り上げたアルカリ土類金属BeとMgの化学ですでに明らかであった。 この後の章では、配位錯体や有機金属化合物における結合と反応性を、大部分共有結合の用語で説明することになる。
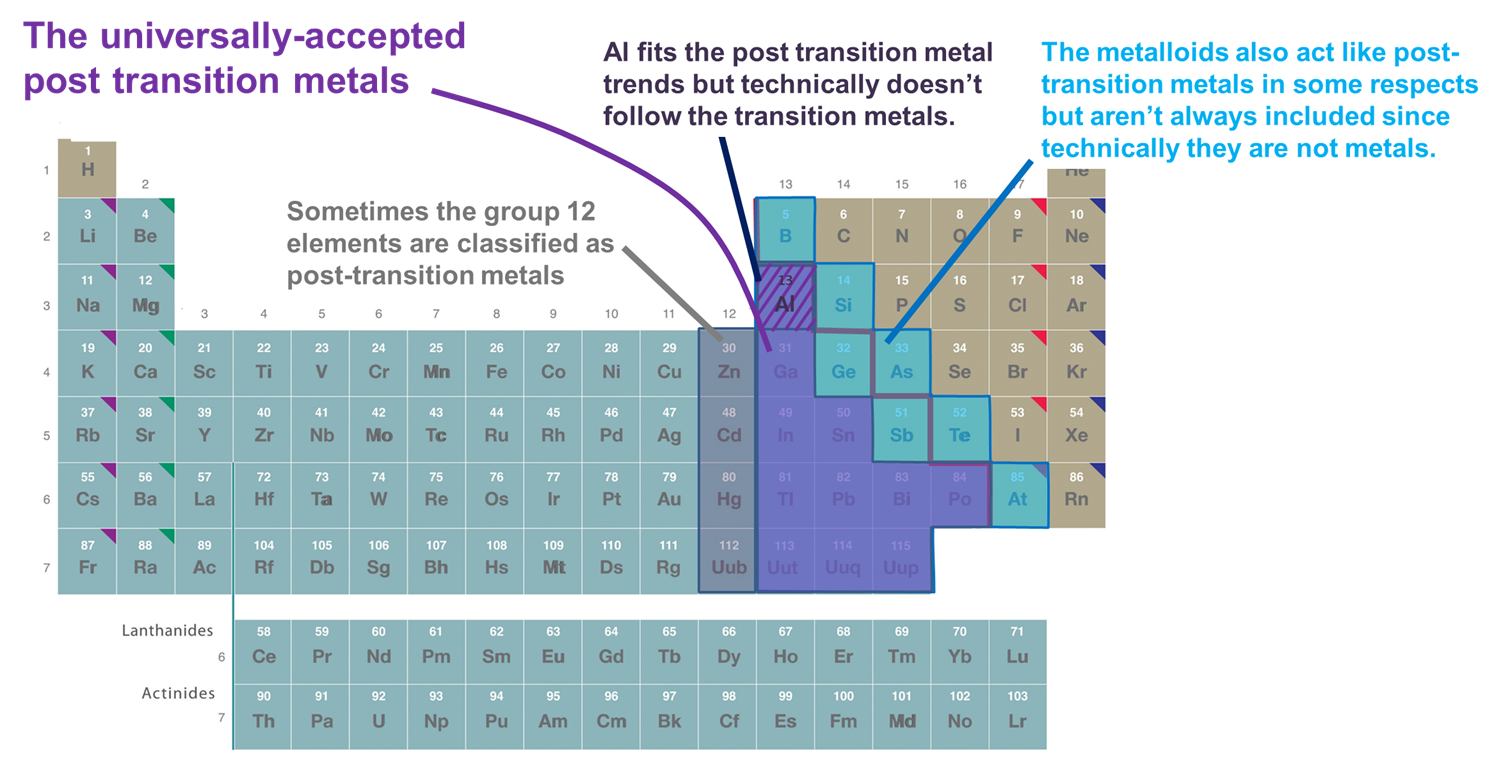
図(㊦㊦㊦). ポスト遷移金属に分類される元素の一部。 紫色で示されたものは金属であり、明らかに遷移金属に従うので一般に受け入れられているが、12族(時には11族)の金属、Al、およびメタロイドはすべて、重要な点で、他のポスト遷移金属に似た振る舞いをするため、含まれることがある。 周期表は https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atoms%2C_Molecules%2C_and_Ions/2.5%3A_The_Periodic_Table.
から引用したものである。
コメントを残す