DNAミニプレップとタンパク質免疫沈降実験に共通することは何でしょうか? スタートは異なりますが、最終的には溶出という重要なステージに到達することは同じです。
用語
まず、基本的な用語から説明します。
溶出 – 溶媒で洗うことによって、ある物質を別の物質から抽出すること。
吸着剤 – 固相で、ミニプレップカラムの場合はシリカゲルですが、通常は抗体やその他のリガンド分子に共有結合できるビーズです。 「
親和性 – 選択した分子(溶出させようとするもの)を結合する吸着剤の能力を示す指標です。 選択した生体分子(BOC)に対する固相の親和性が高いほど、分子は固相に強く結合する。
溶離液 – 吸着剤からBOCを除去した溶媒。
Material Preparation
溶出の前に、汚染を取り除きながら目的の分子を吸収させる必要があります。 これは、”garbage in, garbage out “と言われるように、非常に重要なステップです。 溶出用の優れた試薬があっても、サンプルに無関係なスタッフ(科学用語では「ガンク」)が多ければ、吸着材を詰まらせてしまいます。 固相が飽和すると、BOCが吸着できなくなり、そして溶出液が汚染されることになります。 効果的なライシスとクリーンアップのステップは、溶出実験の成功に不可欠です。
吸着前材料の容量を決定することは重要です。 吸収液を通過するライセートの量は、カラムの3~5容量を超えてはならない。 吸収液を通過するライセートの量が多いと、実験時間が長くなり、また、ガンクが吸収される可能性が高くなります。 多くの場合、ろ過や分画によってライセートの初期体積を減らすことは有意義である。 したがって、ライセートの体積がカラムのサイズを決定する。
吸着材料の選択は、対象となる分子の化学組成に依存する。 生体分子の吸着には、通常、基質と分子との間に多かれ少なかれ特異的な相互作用がある。
タンパク質は通常、IgGで覆われたセファロースまたは磁気ビーズに吸着されます。
最初のライセート適用後、いかなる時点でもカラムが乾燥する可能性はありません。
最初のライセート注入後、カラムを乾燥させないようにしてください。
洗浄
固相を洗浄する目的は、目的の分子をカラムに残したまま、関連性のない物質を除去することです。 イオン強度の低い(例えば塩濃度の低い)バッファーを用いることで選択的な分離を行うことが多い。 洗浄バッファーの量は、最初の物質の量に近く、少なくともカラムの3-5容量になるようにします。
しかしながら、数容量の洗浄バッファーをカラムに通した後、汚染物質は洗い流され、さらに洗浄しても、プレパラートの品質が向上するわけではありません。
溶出
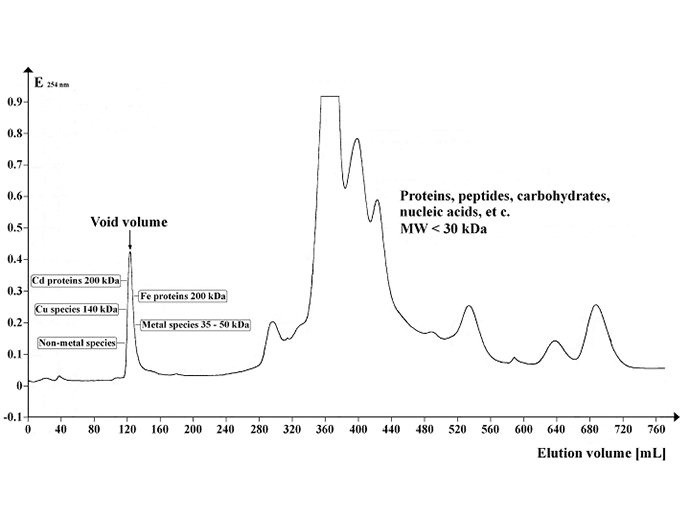
画像はイメージです。 Sephadex G-50 Superfineで分離したシロイヌナズナ上清のUV吸収プロファイルを示すクロマトグラム。 ゲル量:500 mL、カラム長:700 mm、カラム径:30 mm、溶離液流量:1.5 mL。 12 mL / hr; フラクション容量: 8.0 mL; フラクション数: 95; サンプル量: 5 mL; 分離温度: 4 ℃、溶出バッファー。 20 mM Tris-HCl, 1 mM NaN3; pH 8.0。 Image credit: https://commons.wikimedia.org/wiki/File:Chrom_SephG-50.tif
溶出自体は、カラムと基質の結合を破壊する(高塩や溶離液の高温化など)ことで効果を発揮します。
ミニプレップカラムからのDNA溶出は最もシンプルなケースで、1容量のバッファでほぼすべてのDNAが除去されます。 溶出液中のDNA濃度は、使用した溶出バッファーに反比例し、バッファーが多いほど最終的なDNA濃度は低くなります。
カラムの場合、溶出速度は重要です。
カラムの場合、溶出速度は重要で、遅すぎると分子の分解が進み、速すぎるとフラクションが分離しない。
大容量カラムの場合、分子が分散しているので、溶出フラクションを集める必要がある。
分子の種類に応じたOD(DNAの場合は260nm/280nm)をモニターし、各分画中の特定の分子濃度をブロッティングすることが可能です。
結論として、実験の基本パラメータ(吸着剤、カラムのサイズ、洗浄液、溶出液、流速、分画数)と溶出の一般原理を知ることで、溶出をうまくセットアップすることができます。
詳細については、他の研究者が同じようなことを行った記事(同じ分子であることが理想ですが、似たようなものでも構いません)を探し、自分の条件に合うように工夫してください。
コメントを残す