アンモニアとの反応では、なぜ水は酸なのですか?
これは有機化学に重要な意味を持つ、素晴らしい一般化学反応です。 また、似たような質問として、「酸」と反応させたとき、なぜ水は塩基になるのでしょうか。 どちらの質問に対する答えも、「すべては相対的なものだ!」です。 ここStudyOrgoでは、有機化学のトピックについてこのような質問をよく受けます。これは、通常、すぐにカバーされたり、説明が不十分だったり、以前のコースで知っていることが予想されます。 これらの概念は、これから出てくるより複雑なトピックを理解するために本当に重要です。 StudyOrgoの会員になると、有機化学のトピックに関するヒントやトリック、解説付きの詳細なメカニズムをさらに詳しく知ることができます。 今日のブログは、詳細なトピックと資料のプレビューです。 StudyOrgo.comのメンバーシップをチェックして、今日サインアップしましょう!
酸と塩基に関しては、ブレンステッドとルイスの2つの定義があることを覚えておいてください。 ブレンステッド酸はプロトン供与体として、ルイス酸は電子受容体として定義されています。 どちらも酸であるが、プロトンが関与しているか電子が関与しているかで考え方が異なるのである。 水溶液や一般化学、生化学では、酸からプロトンが解離するとH+の溶液濃度が変化し、それをpHの変化と解釈して溶液の「酸性度」を表すので、主にブレンステッドの定義を考えることになる。 酸からのプロトンの解離、すなわち塩基によるプロトンの受け入れは、pKaという数値で測定される。 pKaが大きいほど、酸は弱く、塩基は強くなります。 pKaが小さいほど酸は強く、塩基は弱くなる。 pKaを考える簡単なコツは、プロトン化した分子を左側に置いて、プロトン供与体として考えることです。 pKaはこの供与がどれだけ簡単かを示しており、数字が小さいほどプロトン供与が簡単です。
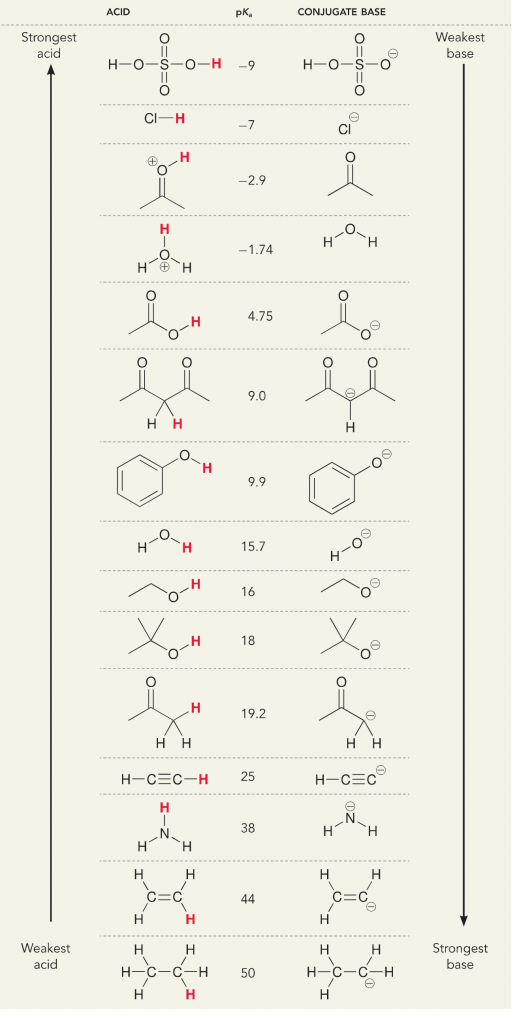
アンモニアと水の反応を見てみましょう。 アンモニアのpKaは~37です。
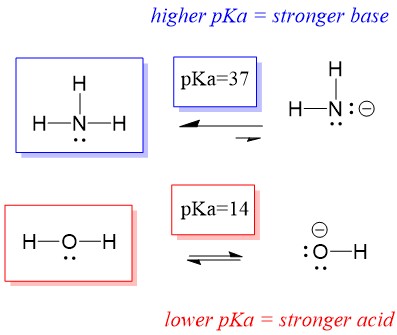
したがって、水のpKaはアンモニアより低いので、アンモニアより強い酸で、アンモニア塩基にプロトンを提供することになる。 この反応により、水は共役塩基OH-となり、アンモニアは共役酸NH4+となります。 興味深いことに、これがアンモニアが腐食剤である理由です。水酸化物を生成して、汚れや微生物と反応し、家庭用品を効果的に洗浄・消毒します。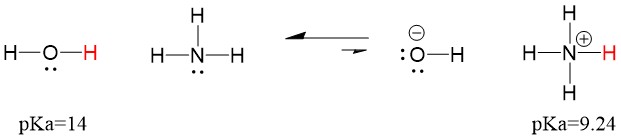
これは有機化学の概念として重要です。電子の観点から見た酸と塩基の強度(ルイス定義)は、まさに結合破壊と結合形成のメカニズムを考える方法、つまり電子の流れになります。 ルイス酸や共役酸の強さは、反応がどの方向に進むかを識別するのに役立ちます。 水とアンモニアの反応は不利ですが、現実には水のpHを著しく低下させるほどの反応が起こります(アンモニアではpH~11)。
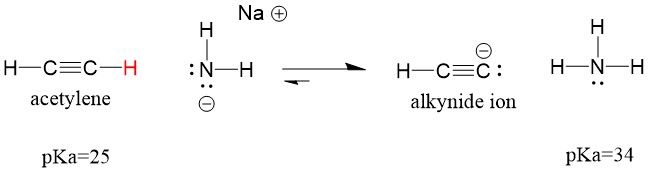
アセチレンが塩基と反応してアルキノイドイオンを生成し、C-C結合形成に有効な求核剤となる様子をみてみましょう。 水酸化ナトリウムをアルキンと反応させても、アルキノイドイオンは生成しません。 これは、反応によって生成する共役酸が水であり、そのpKaは15で、元の酸アセチレン(pKa = 25)よりも強いからです。 反応は常に弱い方の酸、つまりこの場合は反応物側を優先します。
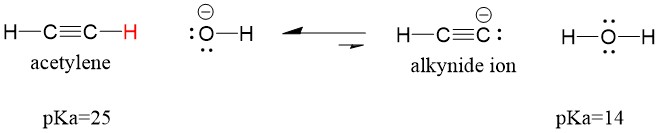
塩基をより強い塩基であるナトリウムアミドに変えると、アルキニドイオンは必ず生成されます。 これは反応の共役酸生成物がアンモニアで、pKaが38と元の酸アセチレン(pKa=25)より弱い共役酸だからです。 この場合、反応は生成物側に有利になる!
 となる。
となる。
コメントを残す