Dipool – dipoolkrachten
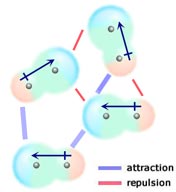
Als twee neutrale moleculen, die elk een permanent dipoolmoment hebben, zo bij elkaar komen dat hun tegengesteld geladen uiteinden op één lijn liggen, worden ze door elkaar aangetrokken. In een vloeistof of vaste stof worden deze uitlijningen bevoordeeld boven die waarbij de uiteinden van de moleculen met gelijke lading dicht bij elkaar liggen en elkaar dus afstoten.
Een van de redenen waarom CH3F een hoger kookpunt heeft (-84 °C) dan CF4 (-128 °C) is dat CF3H een permanent dipoolmoment heeft, terwijl CF4 dat niet heeft. Om dit goed te begrijpen moet je weten dat CF4 tetrahedraal van vorm is en CH3F ruwweg tetrahedraal (er is geen groot verschil in de vormen van deze moleculen). De koolstof-fluor bindingen in beide moleculen zijn polair (fluor is veel elektronegatiever dan koolstof), maar de aanwezigheid van vier C-F bindingen in het tetrahedrale CF4 molecuul maakt het molecuul in zijn geheel niet-polair. Het dipoolmoment van de enkele C-F binding in CH3F wordt niet teniet gedaan door de dipolen van de C-H bindingen (die zeer klein zijn) zodat CH3F wel een permanent dipoolmoment heeft.
Een type intermoleculaire kracht die in bepaalde omstandigheden kan ontstaan en die gewoonlijk wordt geclassificeerd als een dipool-dipool interactie, hoewel zij enig covalent bindingskarakter heeft, is waterstofbinding.
Geef een antwoord