Wat hebben DNA-minipreps en immunoprecipitatie-experimenten met eiwitten gemeen? Ze beginnen verschillend, maar ze eindigen met dezelfde kritieke stap: elutie. Maar wat is elutie precies, en wat is het nut?
De terminologie
Laten we eerst beginnen met wat basisterminologie:
Elutie – het extraheren van een materiaal uit een ander door te wassen met een oplosmiddel.
Het adsorbens – een vaste fase, die een silicagel kan zijn in het geval van mini-prep-kolommen, maar meestal kralen die covalent kunnen worden gekoppeld aan antilichamen of andere ligandmoleculen. “Vaste fase” betekent niet noodzakelijkerwijs een staande kolom; het kunnen ook korrels in een eppendorf zijn die gemakkelijk kunnen worden gewassen.
Affiniteit – een maat voor het vermogen van het absorptiemiddel om het gewenste molecuul te binden (datgene wat u probeert te elueren). Hoe hoger de affiniteit van de vaste fase met het biomolecuul van keuze (BOC), hoe nauwer het molecuul zich eraan bindt. Je wilt echter niet dat de binding onomkeerbaar is; dan wordt de elutie onmogelijk.
Eluent – een oplosmiddel dat BOC van het adsorbens verwijdert.
Eluaat – het oplosmiddel dat BOC bevat dat van het adsorbens is verwijderd.
Materiaalvoorbereiding
Vóór de elutie moet je het gewenste molecuul absorberen en tegelijk de verontreiniging verwijderen. Dit is een essentiële stap, zoals de conventionele wijsheid ons herinnert “garbage in, garbage out.” U kunt uitstekende reagentia voor elutie hebben, maar als uw monster te veel van het niet-verwante personeel bevat (de wetenschappelijke term is “gunk”), zal het het adsorptiemateriaal verstoppen. Verzadiging van de vaste fase zal de absorptie van uw BOC verhinderen en vervolgens het eluaat verontreinigen. De effectieve lysis- en clean-upstappen zijn essentieel voor het succes van uw elutie-experiment.
Het is belangrijk om het volume van uw pre-absorptiemateriaal te bepalen. Het volume van het lysaat dat door het absorptiemedium gaat, mag niet groter zijn dan 3 – 5 volumes van de kolom. Het grote volume lysaat dat door het absorptiemiddel passeert, verhoogt de tijd van het experiment en de kans op de absorptie van gunk. In veel gevallen loont het de moeite om het oorspronkelijke volume van het lysaat te verminderen door filtratie of fractionering. Het volume van het lysaat bepaalt dus de grootte van de kolom.
De keuze van het adsorptiemateriaal hangt af van de chemische samenstelling van het molecuul dat u interesseert. De absorptie van biomoleculen gaat meestal gepaard met een meer of minder specifieke interactie tussen het substraat en het molecuul. DNA wordt bijvoorbeeld geabsorbeerd op minikolommen door ionische interactie tussen negatief geladen DNA-fosfaatgroepen en positief geladen silica-deeltjes.
Eiwitten worden gewoonlijk geadsorbeerd op sepharose of magnetische korrels bedekt met IgG.
Na een eerste toepassing van het lysaat mag uw kolom op geen enkel moment uitdrogen. Dit zal uw molecule aan het absorptiemiddel “bakken” en de integriteit van de kolom verstoren. Als u geen tijd hebt om het experiment voort te zetten, vult u de kolom aan met een compatibele buffer en stopt u de stroom.
Wassen
Het doel van het wassen van de vaste fase is het verwijderen van een niet-gerelateerd materiaal, terwijl het interessante molecuul op de kolom achterblijft. De selectieve scheiding wordt vaak bereikt door een buffer met lage ionische sterkte te gebruiken (b.v. een lage zoutconcentratie). Het volume van de wasbuffer moet ongeveer gelijk zijn aan de hoeveelheid oorspronkelijk materiaal en ten minste 3-5 volumes van de kolom bedragen.
Na verscheidene volumes van de wasbuffer die door de kolom zijn gegaan, zullen de verontreinigingen echter zijn weggespoeld en zal elke extra wasbeurt de kwaliteit van uw prep niet verbeteren. Bovendien zult u uw doelmateriaal beginnen te verliezen.
Elutie
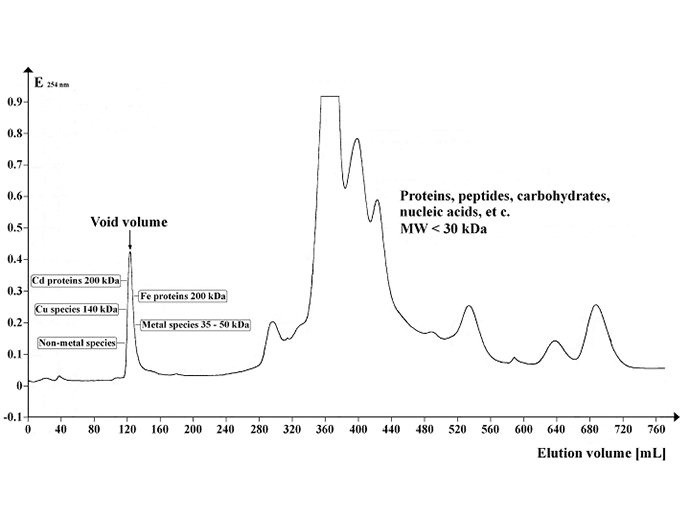
Afbeelding: Chromatogram met het UV-absorptieprofiel van Arabidopsis supernatant, gescheiden op Sephadex G-50 Superfine. Gelvolume: 500 ml; kolomlengte: 700 mm; kolomdiameter: 30 mm; eluentdebiet: 12 ml/uur; fractievolume: 8,0 ml; aantal fracties: 95; monstervolume: 5 mL; scheidingstemperatuur: 4 °C; elutiebuffer: 20 mM Tris-HCl, 1 mM NaN3; pH 8.0. Image credit: https://commons.wikimedia.org/wiki/File:Chrom_SephG-50.tif
Elutie zelf werkt omdat u de bindingen tussen de kolom en het substraat verstoort (d.w.z. door een hoog zout of een hoge temperatuur van het eluent te gebruiken). Elutie gebeurt meestal in een klein volume buffer dat verenigbaar is met monsteropslag en verdere toepassingen.
DNA-elutie uit de mini-prep-kolom is het eenvoudigste geval: één volume buffer verwijdert vrijwel al het DNA. De DNA-concentratie in het eluaat is omgekeerd evenredig met de gebruikte elutiebuffer: hoe meer buffer u gebruikt, hoe lager de uiteindelijke DNA-concentratie. Maar zelfs in dit geval bevelen de meeste fabrikanten aan een extra volume te gebruiken om al het DNA te verwijderen.
Voor de kolommen is de elutiesnelheid van cruciaal belang. Een te lage snelheid verhoogt de kans op degradatie van het molecuul; een te hoge snelheid leidt tot geen resolutie van de fracties.
Voor kolommen met een groot volume moeten eluaatfracties worden verzameld omdat het molecuul over deze fracties zal worden verdeeld. De eerste fractie zal een mix van was- en elutiebuffer bevatten en mogelijke verontreiniging die niet door de wasbuffer is verwijderd.
U kunt de OD voor uw type molecuul controleren (260nm/280nm voor DNA) en een blot doen voor uw specifieke molecuulconcentratie in elke fractie. In het eenvoudigste geval zal uw molecuulverdeling een eenvoudige bell curve volgen, maar het kan een of meer scherpe pieken hebben.
Tot slot, als u de basisparameters van uw experiment kent (absorbent, grootte van de kolom, wasbuffer, elutiebuffer, debiet, aantal van de fracties) en de algemene principes van elutie, zult u uw elutie met succes kunnen opzetten.
Voor meer details, zoek een artikel waar andere wetenschappers iets soortgelijks hebben gedaan – idealiter hetzelfde molecuul, maar een soortgelijk zal volstaan – en pas het aan uw conditie aan.
Geef een antwoord