Van Proteopedia
proteopedia linkproteopedia link
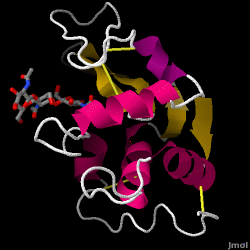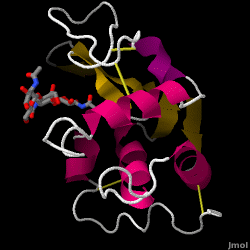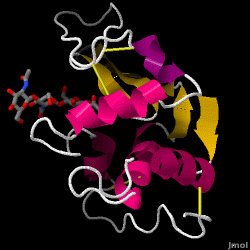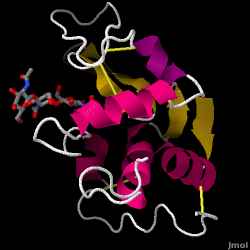
Lysozym – ook bekend als muramidase – is een krachtig enzym dat in overvloed wordt aangetroffen in tranen, speeksel en menselijke melk. Bij de mens wordt het gecodeerd in het LYZ-gen. Aangezien het een klein, gemakkelijk beschikbaar, en zeer stabiel eiwit is, is het onderwerp geweest van uitgebreid onderzoek betreffende zijn functie en structuur.
Inleiding
Lysozym werkt als een niet-specifieke verdediging tegen bacteriën en schimmels. Het is een onderdeel van het aangeboren immuunsysteem, en is een belangrijk onderdeel van de voeding van een zuigeling om diarree af te wenden. Het is een enzym dat bekend staat om zijn vermogen de polysaccharide-architectuur van vele soorten celwanden af te breken, normaal gesproken ter bescherming tegen bacteriële infectie. De structuur van kippenei-eiwit (HEW) lysozym, waarop dit artikel is toegespitst, is hiernaast afgebeeld. De antibacteriële activiteit van kippenei-eiwit werd voor het eerst beschreven door Laschtschenko in 1909. Het werd gekarakteriseerd en “lysozym” genoemd door Alexander Fleming, dezelfde persoon die gecrediteerd wordt voor de ontdekking van penicilline. De ontdekking van de enzymatische activiteit gebeurde bij toeval; tijdens een niet-verwant experiment werden per ongeluk neusdruppels in een petrischaaltje gebracht dat een bacteriecultuur bevatte, welke cultuur vervolgens de resultaten vertoonde van een tot dan toe onbekende enzymatische reactie. De waarneming van deze onbekende reactie leidde tot verder onderzoek naar de componenten van deze reactie en tot de overeenkomstige identificatie van het pas ontdekte “lysozym”. In 1965 bepaalden David C. Phillips en zijn medewerkers de driedimensionale structuur van lysozym met een resolutie van 2 Å. Phillips’ werk was vooral baanbrekend omdat Phillips erin geslaagd was de structuur van een enzym via röntgenkristallografie op te helderen – een prestatie die nog nooit eerder was geleverd. Phillips’ onderzoek leidde ook tot een op structuur gebaseerde hypothese over het werkingsmechanisme.
Functie
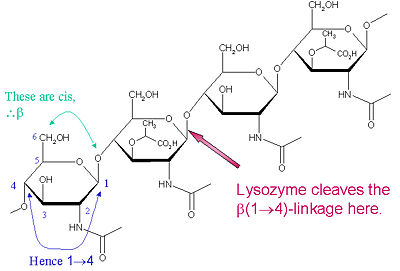
Het specifieke substraat van voorkeur voor dit splijtingstype is een (NAG-NAM)₃ hexasacharide, waarbinnen het substraat de splijtende doelglycosidebinding, NAM₄-β-O-NAG₅, bevat. De afzonderlijke hexasaccharide bindingseenheden worden aangeduid als A-F, waarbij de voorkeur voor splitsing van de NAM₄-β-O-NAG₅ glycosidebinding overeenkomt met een D-E eenheid glycosidebinding cl
Lysozym is bekend voor het beschadigen van bacteriële celwanden door het katalyseren van de hydrolyse van 1.,4-bèta-bindingen tussen N-acetylmuraminezuur (NAM) en N-acetyl-D-glucosamine (NAG) residuen in peptidoglycaan, en tussen N-acetyl-D-glucosamine residuen in chitodextrinen. Op deze wijze is lysozym efficiënt in het lyseren van de celwanden van zowel bacteriën als schimmels. De plaats van splitsing voor lysozym op dit architectonische thema is de β(1-4) glycosidische koppeling die de C1-koolstof van NAM verbindt met de C4-koolstof van NAG.
Het specifieke substraat van voorkeur voor dit splijtingstype is een (NAG-NAM)₃ hexasaccharide, waarbinnen het substraat de splijtende doelglycosidebinding, NAM₄-β-O-NAG₅, bevat. De afzonderlijke hexasacharidebindingseenheden worden aangeduid met A-F, waarbij de voorkeur voor splijting van de NAM₄-β-O-NAG₅-glycosidebinding overeenkomt met een voorkeur voor splijting van de D-E-eenheid-glycosidebinding. Afhankelijk van het organisme waaruit lysozym wordt verkregen, verloopt de hydrolyse van de glycosidebinding met behoud van de configuratie bij de anomere koolstof (kippeneiwit) of met inversie (gans, faag T4).
Lysozym werkt efficiënt op lange (NAG-NAM) of (NAG) polymeren. Naarmate de ketenlengte kleiner wordt dan zes monomeren, daalt de katalytische snelheid aanzienlijk; in feite fungeren trisacchariden als competitieve remmers door zich te binden aan de actieve site in een niet-productief register.
Hen eitwit lysozym (PDB-code 1hew)
Mechanisme
Hydrolyse van glycosidebindingen door het lysozym van het kippenei verloopt met behoud van configuratie. In 1953 stelde Koshland voor dat in het algemeen het vasthouden van de configuratie een dubbel verplaatsingsmechanisme impliceert (terwijl het omkeren van de configuratie een enkele verplaatsing impliceert). Tientallen jaren lang werden twee concurrerende mechanistische hypothesen (Phillips: dissociatief mechanisme met oxocarbenium intermediair; Koshland: tweestaps associatief mechanisme met covalent enzymcomplex als intermediair) overwogen, waarbij de gegevens van 2001 de weegschaal deden doorslaan in de richting van het bestaan van een covalent intermediair. Het ontbreken van een substraatcomplexstructuur heeft zeker bijgedragen tot moeilijkheden bij het onderscheiden van mogelijke mechanismen, evenals het bestaan van twee verschillende mechanismen (retentie en omkering van configuratie) binnen dezelfde structurele familie van enzymen (bv. kippen- vs. ganzenenzym).
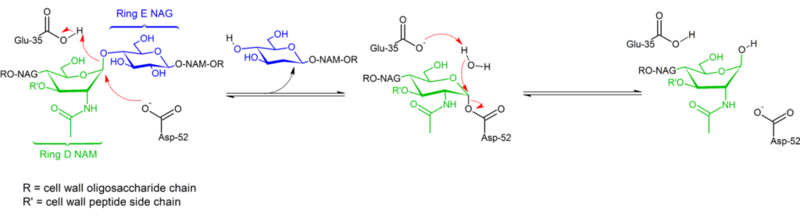
Lysozym hydrolyseert een glycoside (vandaar de familiaire classificatie van lysozym als glycosylase), wat overeenkomt met de omzetting van een acetaal in een hemiacetaal. De reactie verloopt in twee stappen, zoals in de bovenstaande figuur is aangegeven. In de eerste stap fungeert Asp 52 als nucleofiel en is een deel van de suiker de uittredende groep. In de tweede stap fungeert water als nucleofiel en Asp 52 als uittredende groep. In beide stappen wordt de configuratie bij de anomere koolstof omgekeerd, wat leidt tot een algemeen behoud van configuratie. Glu 35 werkt als een zuur in de eerste stap (protoneren van de suiker de glycosidebinding om het een beter elektrofiel te maken) en als een base in de tweede stap (deprotoneren van water om het een beter nucleofiel te maken). Terwijl de figuur sommige suikers in een bootconformatie toont om de omkering van configuratie te benadrukken, worden deze niet experimenteel waargenomen maar eerder gevonden in een stoelconformatie.
Toepassingen van lysozym
Omdat lysozym algemeen erkend is voor zijn antibacteriële en schimmelwerende eigenschappen, heeft het een grote verscheidenheid van toepassingen, zowel in biochemische als in farmaceutische toepassingen. In de moleculaire biologie wordt lysozym vaak gebruikt in de alkalische-lise-procedure voor het extraheren en isoleren van plasmide-DNA. Het wordt op grote schaal gebruikt in de farmaceutische sector voor de vernietiging van grampositieve bacteriën, en kan worden gebruikt ter ondersteuning van reeds bestaande immuunafweer ter bestrijding van bacteriële infecties. Dit enzym is bijzonder belangrijk voor de preventie van bacteriële ziekten bij zuigelingen. Vanwege zijn antibacteriële eigenschappen kan lysozym ook in de voedingsmiddelenindustrie worden gebruikt om bederf van voedingsmiddelen te helpen voorkomen.
Zie ook
- Lysozym 3D-structuren
- Lysozym
- Vasthoudende glycosidehydrolasen
- Molecular Playground/Lysozym
- Gebruiker:Judy Voet/Lysozyme
- Lysozyme (Arabisch)
- Lysozyme (hebreeuws)
- Ragland SA, Criss AK. Van bacteriële doding tot immuunmodulatie: Recente inzichten in de functies van lysozym. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming, A. (1922) On a remarkable bacteriolytic element found in tissues and secretions. Proc.Roy.Soc.(London),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structuur van kippenei-eiwit lysozym. Een drie-dimensionale Fourier synthese bij 2 Angstrom resolutie. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. An Introduction to Enzyme and Coenzyme Chemistry. Blackwell Science Ltd., Oxford
- Earliest Solutions for Macromolecular Crystal Structures.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Crystallographic studies of the activity of hen egg-white lysozyme. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Afbeelding van: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Vroege linttekeningen van eiwitten. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structuur van kippenei-eiwit lysozym. A three-dimensional Fourier synthesis at 2 Angstrom resolution. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Structure of some crystalline lysozyme-inhibitor complexes determined by X-ray analysis at 6 Angstrom resolution. Nature. 1965 May 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers and Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Proteopedia Page Contributors and Editors (wat is dit?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
Geef een antwoord