- Introduction
- Experimenteel
- Materialen
- Synthese van intercalatieverbindingen
- Karakterisering
- Resultaten en Discussie
- XRD karakterisering
- FTIR-spectra
- Structureel model van Kaol/alkylamine intercalatie verbindingen
- Thermische analyse
- De kinetiek van de afbraakreactie
- Conclusies
- Bijdragen van auteurs
- Conflict of Interest Statement
- Acknowledgments
Introduction
Ontwerp en fabricage van klei/polymeer nanocomposieten hebben veel belangstelling getrokken van zowel de wetenschappelijke als de engineering gemeenschappen (Cheng et al., 2017). Een grote verscheidenheid van klei / polymeer nanocomposieten zijn ontwikkeld en worden gebruikt in wijdverspreide toepassing (Gogoi en Raidongia, 2017). Pre-intercalatie van klei gevolgd door de integratie van polymeren in kleimineralen laag is een veel gebruikte aanpak voor de bereiding van klei / polymeer nanocomposieten (Li et al., 2009; Zare et al., 2017). Terwijl ze intercaleren binnen anorganische kleilagen, verminderen organische polymeerketens van nature hun structurele mobiliteit en nemen sommige van hen een zeer georganiseerde conformatie aan binnen de gelaagde structuur.
In de natuur is kaoliniet (Kaol) een type kleimineraal met een 1:1 dioctahedral aluminiumsilicaat gelaagde structuur (Brindley en Robinson, 1945). De lagen in Kaol worden bijeengehouden door waterstofbruggen, dipool-dipool interacties, en van der Waals krachten (Brindley et al., 1967). Slechts een beperkt aantal sterk polaire organische stoffen, waaronder ureum (Makó et al., 2009), dimethylsulfoxide (Costanzo en Giesse, 1986), formamide (Frost et al., 2000a), hydrazine (Cruz en Franco, 2000) en kaliumacetaat (Frost et al., 2000b) werden echter met succes in de galerij van Kaol geïntercalpeerd. De intercalatie van kleine moleculen in Kaol-lagen veroorzaakt een toename van de basale spatiëring, en kan worden gebruikt als een voorafgaande expansiestap voor de daaropvolgende invoeging van grote, niet-reactieve soorten door de verplaatsing van de pre-geïntercaleerde kleine moleculen (Cheng et al., 2015). Bijvoorbeeld, op basis van de eerdere rapporten, kan een Kaol/methanol intercalatieverbinding een effectief tussenproduct zijn voor verdere intercalatiereactie met ethyleenglycol (Hirsemann et al., 2011), hexylamine (Matusik et al., 2012), n-alkylamines (Gardolinski en Lagaly, 2005), en quaternaire ammoniumzouten (Cheng et al., 2016). Bovendien is de meerderheid van de gastmoleculen moeilijk om in de tussenlaagruimte te worden ingevoegd, een van de redenen is de sterke waterstofbruggen, een andere is dat er geen uitwisselbare ionen in de Kaol-structuur zijn.
Hoewel klei/polymeer nanocomposieten de laatste jaren goed zijn ontwikkeld, vormt de synthese van nieuwe klei/organische nanocomposieten voor potentiële toepassing nog steeds een grote uitdaging (Kotal en Bhowmick, 2015). Om dit probleem op te lossen, is het dringend nodig om het nanoschaalproces van kaolinietintercalatie te achterhalen en het ontledingsmechanisme grondig te onderzoeken met moderne technologie en analytische instrumenten. Thermische analyse en kinetische berekening van klei/polymeer intercalatieverbindingen kunnen helpen om de ontledingsprocessen te karakteriseren en een wetenschappelijke basis te verschaffen voor controle over intercalatiereacties (Zhang et al., 2015). De kinetische parameters van het ontledingsreactieproces, zoals de activeringsenergie, pre-exponentiële, reactie-orders, en de snelheidsconstante werden beoordeeld met de gegevens van klei/polymeer thermogrammen. In deze studie werd de intercalatie van Kaol met verschillende alkylamines onderzocht. Bovendien werden het intercalatieproces en het ontledingsmechanisme systematisch onderzocht.
Experimenteel
Materialen
Kaolien dat in deze studie werd gebruikt, werd gewonnen uit Zhangjiakou, China. De belangrijkste minerale samenstelling is een goed geordend kaoliniet (95% in massa). Het werd gemalen tot het een 325-mesh zeef passeerde (deeltjes die < 44 μm meten) vóór intercalatie. Alkylamine hexylamine (HA, 99%), dodecylamine (DA, chemisch zuiver), en octadecylamine (OA, chemisch zuiver) werden gekocht bij Nanjing Shuguang Chemical Company, China. Dimethylsulfoxide (DMSO, analytisch reagens), methanol (MeOH, analytisch reagens) en tolueen (99%) werden verkregen van Xilong Chemical Company, China, en gebruikt zoals ze waren zonder verdere zuivering. De chemische formule en structuurformule van HA, DA, en OA worden weergegeven in tabel 1.

Tabel 1. Chemische en structuurformule van HA, DA, en OA.
Synthese van intercalatieverbindingen
Eerst werd de Kaol/DMSO intercalatieverbinding bereid door 20,0 g Kaol te dispergeren in een mengsel van 36,0 g DMSO en 4,0 g water. Het mengsel werd gedurende 2 uur bij 95 °C in een waterbad geroerd, waarna de suspensie werd afgescheiden door centrifugering met ethanol. Ten tweede werd de Kaol/DMSO-intercalatieverbinding gebruikt als precursor voor verdere reactie met MeOH. MeOH werd toegevoegd aan het voorgeïntercaleerde Kaol en het reactiemengsel werd gedurende 10 dagen geroerd, waarbij MeOH elke dag werd vervangen door eenzelfde hoeveelheid vers MeOH. Het neerslag in het mengsel werd door centrifugeren afgescheiden en gedurende 12 uur in een oven bij 60 °C gedroogd om Kaol/MeOH-intercalatieverbindingen te verkrijgen. Ten slotte werd 2 g Kaol/MeOH intercalatieverbinding gemengd met 30,0 mL HA, DA, of OA methanoloplossingen (1 mol/L) door roeren bij omgevingstemperatuur, respectievelijk. De dispersies werden na de reactie gedurende 24 uur gecentrifugeerd. De sedimenten werden driemaal gewassen met tolueen om het teveel aan HA, DA of OA te verwijderen. De monsters werden gedurende 12 uur bij kamertemperatuur gedroogd en met een agaatvijzel tot poeders vermalen (Komori et al., 1999). De resulterende verbindingen worden aangeduid als Kaolpi/HA (pi als pre-intercalated), Kaolpi/DA, en Kaolpi/OA.
Karakterisering
De XRD-patronen werden opgenomen op een Rigaku D/max 2500PC röntgendiffractometer met Cu Kα (λ = 1,54178 Å) straling die werkt bij 40 kV en 150 mA. De willekeurig georiënteerde proefstukken werden gescand in het 2θ-bereik tussen 1 en 20° bij een snelheid van 2° min-1. Een Thermo Fisher Nicolet 6700 spectrofotometer werd gebruikt om de FTIR spectra op te nemen binnen het bereik van 4000~400 cm-1. De TG-DSC-analyses werden uitgevoerd met een Mettler-Toledo TG-DSC I/1600 HT simultaan thermisch analyseapparaat onder stikstofatmosfeer. Twintig milligram monster werd geplaatst in een aluminiumoxide smeltkroes en verwarmd van 30 tot 1100 ° C met een reeks van verwarming tarieven op 4, 6, 8, 10 ° C min-1.
Resultaten en Discussie
XRD karakterisering
De XRD patronen van de ongerepte Kaol en de intercalatie verbindingen worden getoond in figuur 1. De patronen van de ongerepte Kaol en de intercalatie verbindingen worden getoond in figuur 1. Het patroon van het zuivere Kaol vertoont een goed geordende gelaagde structuur met een basale afstand van 0,71 nm. Deze waarde komt goed overeen met het standaard ICDD-referentiepatroon 14-0164 . Na behandeling met DMSO, een nieuwe basale reflectie piek verscheen op 1,14 nm, wat aangeeft dat DMSO met succes werd ingevoegd in Kaol interlayers. Nadat de Kaol/DMSO intercalatie verbinding werd behandeld met MeOH, werd de 1,14 nm (001) reflectie kenmerk van Kaol/DMSO intercalatie verbinding verschoven naar 0,86 nm. Matusik et al. (2012) meldden dat de Kaol/DMSO/MeOH-verbinding bij 110 °C werd gedroogd, de reflectie met d = 1,12 nm verdween en een brede reflectie met maximum bij 0,95 nm werd waargenomen. Op basis van de chemische formule Al2Si2O5(OH)3.20(OCH3)0.80 van Kaol/DMSO intercalatieverbinding die berekend is op basis van CHNS-analyse, bleek dat ongeveer 1/3 van de OH-groepen aan het binnenoppervlak vervangen waren door methoxygroepen, en deze waarneming suggereert ook de vorming van een Kaol/MeOH intercalatieverbinding (Tunney en Detellier, 1996; Cheng et al., 2015). De XRD-patronen laten ook zien dat de Kaol/MeOH-verbindingen intercaleerden met HA, DA, en OA de structuur langs de c-as uitbreidt, wat leidt tot een grote interlaagafstand van respectievelijk 2,86, 4,08, en 5,66 nm. De lengtes van HA, DA en OA molecuulketens zijn respectievelijk 1,56, 2,51 en 3,65 nm (McNulty et al., 2011, 2014). Over het geheel genomen nam de interlaagafstand van de Kaol/alkylamine intercalatieverbindingen toe met de alkylketenlengte van de alkylamines, maar het alkylaminemolecuul is geen eenlaagse of tweelaagse structuur die loodrecht op het Kaol-oppervlak staat.
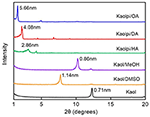
Figuur 1. XRD-patronen van Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA, en Kaolpi/OA.
FTIR-spectra
FTIR-spectroscopie is op grote schaal gebruikt bij de karakterisering van intercalatieverbindingen (Ledoux en White, 1964; Frost et al., 2000c; Cheng et al., 2012). De FTIR-spectra van de originele Kaol, Kaolpi/HA, Kaolpi/DA, en Kaolpi/OA intercalatieverbindingen worden getoond in figuur 2. De karakteristieke banden bij 432, 470 en 541 cm-1 (figuur 2B) behoren tot de vervormingswijze van Si-O, Si-O-Si, en Al-O-Si. De andere banden bij 1.009, 1.031, en 1.114 cm-1 (figuur 2C) worden toegewezen aan de strekvibraties van Si-O-Si in de laag van Kaol. Bij vergelijking van de spectra van Kaol en zijn intercalatieverbindingen is er geen duidelijke variatie in de positie van de banden, wat erop wijst dat deze strekvibratiebanden niet worden beïnvloed door de intercalatiemoleculen.
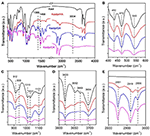
Figuur 2. Infraroodspectra van Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
De banden bij 912 en 938 cm-1 (figuur 2C) behoren tot de OH vervorming van binnenste hydroxylgroepen en binnenste-oppervlakte hydroxylgroepen. Er zijn vier duidelijke hydroxylstrekbanden bij 3.694, 3.669, 3.652 en 3.620 cm-1 (figuur 2D) in het spectrum van het oorspronkelijke Kaol, de banden bij 3.694, 3.669 en 3.652 cm-1 worden veroorzaakt door de hydroxylgroepen aan de binnenzijde, terwijl die bij 3.620 cm-1 het gevolg is van de hydroxylgroepen aan de binnenzijde (Farmer, 1964; Ledoux en White, 1964; Giese en Datta, 1973). Na de intercalatie van alkylamine moleculen werden sommige banden verzwakt als gevolg van de verandering van de interacties met naburige atomen. De verschuiving naar 3.697 cm-1 en de afname van de intensiteit van de band bij 3.694 cm-1 geeft aan dat talrijke hydroxylgroepen in Kaol deelnamen en waterstofbruggen vormden met de aminegroepen in de alkylaminemoleculen (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
De aanwezigheid van tussenlaagse alkylaminemoleculen werd gedetecteerd op het FTIR-spectrum door de nieuwe pieken, die worden getoond in Figuren 2A,E. Voor de intercalatieverbindingen behoren enkele duidelijke karakteristieke pieken, zoals de band bij 1.388 en 1.468 cm-1 tot de C-H buigmodus van -CH3 en -CH2, respectievelijk. Een nieuwe trillingsband bij 3.334 cm-1 werd waargenomen die toe te schrijven is aan de strekkingsmodus van de N-H strekkingsvibratie (Griffiths en De Haseth, 2007; Zhang et al., 2018). De nieuwe trillingsband bij 2.956 cm-1 werd waargenomen en gewoonlijk toegewezen aan de C-H asymmetrische strekkingsband van de eindmethylgroepen (Cheng et al., 2016). De twee trillingsbanden bij 2.919 en 2.851 cm-1 worden gewoonlijk toegewezen aan de symmetrische en asymmetrische strekvibraties van de -(CH2)n- (Venkataraman en Vasudevan, 2001). De intensiteit van de banden neemt geleidelijk toe, wat betekent dat meer alkylamine koolstofatomen in de Kaol-interlagen zijn ingebracht. Bovendien zal de vluchtigheid van alkylamines afnemen met de toename van de koolstofketen, dus de stabiliteit van de overeenkomstige Kaol intercalatie verbindingen zal geleidelijk toenemen met grotere alkylamine molecuulmassa (Wang et al., 2010).
Structureel model van Kaol/alkylamine intercalatie verbindingen
De rangschikking van de intercalatie moleculen is de basis voor experimentele analyse van de structuur van de Kaol/alkylamine intercalatie verbinding. Volgens Lagaly (1981) kunnen de structuurmodellen van montmorilloniet-quaternair ammoniumzout intercalatieverbindingen in drie categorieën worden verdeeld: (a) monolagen: korte keten alkylamine-ionen; b) bilagen: lange keten quaternaire ammoniumionen; c) drielagen: geknikte alkylketens in sterk geladen kleimineralen. Beneke en Lagaly (1982) stelden verder verschillende structuren voor van de geïntercaleerde alkylamine moleculen op basis van de XRD, die als volgt worden samengevat: (a) de alkylketens in de tussenlaagruimte zijn gekanteld ten opzichte van het (001) kristalvlak; (b) de alkylketens zijn gerangschikt in bilayers. Brindley en Moll (1965) beschreven dat de intercalerende moleculen gekanteld zijn ten opzichte van de silicaatplaten in een enkele laag, terwijl de hoek ongeveer 65° bedraagt ten opzichte van het (001) kristalvlak. Als de interagerende moleculen uniform gehecht zijn aan alle silicaatoppervlakken door de actieve hydroxylgroepen, wordt een “end to end” organisatie in paren met enige longitudinale verplaatsing gesuggereerd. De hellingshoek is in overeenstemming met de mogelijke nauwe pakkingswijze tussen de silicaatzuurstofoppervlakken en de eindhydroxylgroepen en de graad van nauwe pakking van ketenmoleculen onderling.
De alkylmoleculen zijn moeilijk om direct de originele Kaol-lagen te intercaleren aangezien het uitwisselbare ionen in de tussenlaagruimte van Kaol mist. Geldige precursors zijn essentieel wanneer de alkylamine molecules in de tussenlaag van Kaol invoegen. Er werd gerapporteerd dat de alkyl trimethyl ammoniumchloride keten een gekantelde bilaag vormt in de tussenlaag van Kaol en de hoek van kanteling is ~36° na berekening (Kuroda et al., 2011). Yuan et al. (2013) wezen erop dat de structurele rangschikking van de quaternaire ammoniumzoutmoleculen in de tussenlaag van Kaol een gekantelde bilaag vormt en dat de hoek van kanteling ~38,4° bedraagt. Gardolinski en Lagaly (2005) stelden voor dat de alkylketens in de tussenlagen volledig uitgerekt zijn en loodrecht op het Kaol-oppervlak door de bilaag georiënteerd zijn. Daarom kan uit de analyse van de lengte van de HA-, DA- en OA-molecuulketen worden geconcludeerd dat de basale afstand na intercalatie niet voldoende is om de alkylketen verticaal en via de bilaag te laten binnendringen. Uit de verdere analyse van de XRD-resultaten blijkt dat de alkylketens van HA, DA en OA in de bilaag naar het Kaol-oppervlak zijn gekanteld en dat de hellingshoek van de alkylketens respectievelijk ongeveer 39,9°, 39,9° en 41,1° bedraagt. Bovendien, als gevolg van de hydroxylbinding tussen binnen-oppervlak hydroxyl in Kaol en amine groepen in alkylamine moleculen, de meest mogelijke structurele model voor de Kaol/alkylamine intercalatie verbindingen wordt getoond in figuur 3.
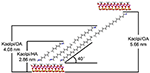
Figuur 3. Het meest mogelijke structuurmodel voor de kaoliniet/alkylamine intercalatieverbindingen.
Thermische analyse
De TG-DSC analyseresultaten van Kaol en de intercalatieverbindingen worden getoond in figuur 4. Het belangrijkste massaverlies van Kaol is dat tussen 400 en 600°C met het maximale verlies bij 525°C toegeschreven aan het verlies van water door de dehydroxylering van het kristalrooster, resulterend in de vorming van meta-kaoliniet (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Dit verlies stemt overeen met ongeveer 12,7% van de totale massa, wat zeer dicht bij de theoretische referentie (13,9%) ligt. Door de TG-DSC-curven van het originele Kaol te vergelijken, worden twee belangrijke massaverliesstappen waargenomen in die van Kaolpi/HA, Kaolpi/DA, en Kaolpi/OA intercalatieverbindingen. De eerste treedt op tussen 150 en 350°C, wat te wijten is aan de ontleding van de geïntercaleerde alkylaminemoleculen (Yuan et al., 2013). De tweede trad op bij ongeveer 500°C en is het gevolg van de dehydroxylering van het gedeïntercaleerde Kaol. Voor Kaolpi/OA, werden sommige OA geïntercalpeerd in de silicaat tussenlaagruimte om een stabiele intercalatie te vormen, wat kan worden bewezen door XRD-patroon. Sommige moleculen zijn in elkaar verstrengeld als gevolg van de lange keten of een klem in de nanorollen die niet volledig kan worden verwijderd (Li et al., 2015; Liu et al., 2016). Bij 220°C is het uitgesproken massaverlies te wijten aan de ontleding van het gecoate of ongebonden OA, terwijl het massaverlies bij 330°C wordt toegeschreven aan de ontleding van geïntercaleerd OA. De exotherme piek bij 996°C is het gevolg van de herkristallisatie van Kaol.
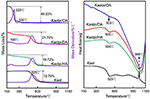
Figuur 4. TG-DSC-curven voor Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Door vergelijking van de TG-DSC-curven van de originele Kaol en Kaol/alkylamine intercalatieverbindingen (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA), kan men waarnemen: (a) er zijn verschillende stappen in het massaverlies, evenals een significant verschil in de massaverliezen tussen Kaolpi/OA en de andere twee intercalatieverbindingen (Kaolpi/HA, Kaolpi/DA). Het massaverlies voor de ontleding van Kaolpi/HA en Kaolpi/DA bedroeg ongeveer 20%, maar het bedrag van de twee massaverliezen voor Kaolpi/OA is ongeveer 50%. Dit zou het gevolg kunnen zijn van het feit dat een grotere hoeveelheid OA in de tussenlaagruimte van het silicaat werd geïntercalpeerd dan dat HA en DA (Wang et al., 2017). (b) De dehydroxylatietemperatuur van de intercalatieverbindingen was lager dan die van het originele Kaol met ongeveer 20°C. Dit komt omdat de intercalatiemoleculen de tussenlaagafstand vergrootten, de waterstofbruggen tussen de Kaol-lagen verzwakten en een gemakkelijkere dehydroxylering van het Kaol-oppervlak bewerkstelligden. Daarom nam de kristalliniteit van Kaol sterk af na intercalatie, wat kan worden bevestigd door XRD en IR (onder 800 cm-1). Dit resultaat is consistent met de conclusie van enkele andere rapporten dat de temperatuur van dehydroxylatie werd bepaald door de kristalliniteit van Kaol (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
De kinetiek van de afbraakreactie
De afbraakkinetiek van de Kaol/alkylamine intercalatieverbinding werd onderzocht met thermogravimetrische technieken. De kinetische parameters (activeringsenergie E en de pre-exponentiële factor A) van het degradatieproces werden berekend op basis van de KAS- en Ozawa methoden (Kissinger, 1957; Škvára en Šesták, 1975). Het thermische afbraakmechanisme van de Kaol/alkylamine intercalatieverbinding werd bestudeerd met de Satava-integraalmethode (Xie et al., 2001; Gao et al., 2005; Zhang et al, 2015).
Volgens de reactietheorie wordt de niet-isotherme ontledingskinetische formule gewoonlijk als volgt uitgedrukt:
waarin α de mate van omzettingssnelheid van B(s) op tijdstip t is, f (α) de reactiemechanismefunctie is, en k de reactiesnelheidsconstante is. k volgt de volgende vergelijking:
Als de temperatuur van het monster wordt geregeld met een constante verwarmingssnelheid (β = dT/dt), kan de reactiesnelheid als volgt worden gedefinieerd:
Na scheiding van de variabele, herschikking met integraal- of differentiaalfuncties van vergelijking (4), kunnen KAS-vergelijking (5), en Ozawa-vergelijking (6) als volgt worden berekend:
Waarbij G(α) de integraalfunctie van de omrekening voorstelt. Vanwege de integrale benadering werden iteratieve methoden gebruikt om E te berekenen om bepaalde afwijkingen te voorkomen. De functies van de iteratieve methoden zijn als volgt:
Zet x = E/RT, dan zijn de definities van h(x) en H(x):
De iteratie verloopt in de volgende drie stappen:
(a) Stel h(x) = 1 of H(x) = 1, bereken E0 met de kleinste kwadratenmethode aan de hand van de helling van het lineaire verband lnβ/T2 en lnβ tot 1/T.
(c) Vervang E0 door E1, herhaal stap (b) tot Ei-Ei-1 < 0. 1 kJ mol-1. Ei is de exacte waarde van de activeringsenergie van de ontledingsreactie.
De E-waarden van Kaol/alkylamine intercalatieverbindingen werden berekend met KAS, Ozawa en iteratieve methoden (tabel 2). De berekende resultaten van de KAS-methode lagen dichter bij de resultaten van de iteratieve methoden, maar de resultaten van de iteratieve methode van Ozawa weken meer af van de andere. Daarom kan de gemiddelde E van de iteratieve methoden worden beschouwd als de activeringsenergie van de ontledingsreactie, aangezien zij een verbetering zijn ten opzichte van de KAS- en Ozawa-methoden. De gemiddelde E van Kaolpi/HA, Kaolpi/DA, en Kaolpi/OA zijn 104,44, 130,80, en 154,59 kJ mol-1. Men kan zien dat de gemiddelde E onder van Kaol/alkylamine verbindingen positief correleren met de alkylketenlengte. Een van de redenen is dat de vluchtigheid afneemt naarmate de alkylketen langer wordt. Een andere reden is dat Kaolpi/OA de best geordende intercalatiestructuur bezit, die het moeilijkst te de-intercaleren is. En deze resultaten kunnen worden bevestigd door XRD-patronen.
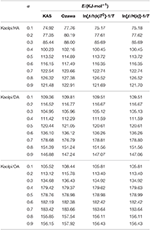
Tabel 2. E van Kaol/alkylamine intercalatie verbindingen met verschillende α berekend door KAS, Ozawa, en iteratie methoden.
De functies en A van decompositie reactiemechanisme werd berekend door Satava methoden, die werd beschreven als volgt:
Substitueer α in elke mechanisme functie G(α) om de waarde van lg te verkrijgen, lineair passend lg, en 1/T die met de verwarmingssnelheid overeenstemt, de functie die de grootste pasvorm heeft kan als de meest waarschijnlijke mechanisme functie worden bepaald. En de waarden van E en A kunnen door de helling en het intercept van een lineaire pascurve worden verkregen.
Zoals getoond in Tabel 3, worden vijf mechanisme functies met goedheid van pasvorm boven 90% gekozen gebaseerd op Satava integraalformule. Door deze vijf functies te vergelijken, kan Nr. 9 mechanisme functie G(α) = 2 met een goodness of fit van ongeveer 97% worden beschouwd als de meest waarschijnlijke mechanisme functie, en de lineaire pascurve van Nr. 9 functie is getoond in Figuur 5. E en A liggen ook in het normale bereik van de ontledingskinetiek. De functies van de ontledingsmechanismen voor de drie Kaol/alkylamine intercalatieverbindingen zijn gegeven in tabel 4.

Tabel 3. Geselecteerde kinetische mechanisme functies beoordeeld door Satava integrale methode.

Figuur 5. Lineaire fitting curves van No. 9 functie beoordeeld door Satava integrale methode.

Tabel 4. Kinetische mechanisme functies van Kaol/alkylamine intercalatie verbindingen.
Conclusies
De mogelijke structuurmodellen en ontledingskinetiek voor Kaol/alkylamine intercalatie verbindingen zijn bestudeerd met behulp van XRD, FT-IR, en TG-DSC. De intercalatie van Kaol/MeOH-verbinding met HA, DA, en OA vergroot de tussenlaagafstand van Kaol langs de c-as, wat resulteert in de dominante reflectie bij respectievelijk 2,86, 4,08, en 5,66 nm. Bovendien is de basale afstand na intercalatie niet voldoende om de alkylketen binnen te laten gaan door verticale enkelvoudige en tweelagige manier. Geconcludeerd werd dat de alkylketens van HA, DA en OA gekanteld zijn naar het Kaol oppervlak in bilayer en de hellingshoek van de alkylketens zijn ~40°.
Gebaseerd op de KAS, Ozawa, en iteratieve methoden, werden de resultaten van activeringsenergie E van Kaol/alkylamine intercalatieverbindingen berekend. De gemiddelde activeringsenergie E van Kaolpi/HA, Kaolpi/DA, en Kaolpi/OA zijn 104,44, 130,80, en 154,59 kJ mol-1. De gemiddelde activeringsenergie E van Kaol/alkylamineverbindingen heeft een positieve correlatie met de alkylketenlengte. De geoptimaliseerde mechanisme functie van Kaol/alkylamine ontbindingsproces werd bepaald als een 3D-diffusie met de integrale functie G(α) = 2. Dit onderzoek is nuttig om het ontledingsmechanisme van klei/organische nanocomposieten beter te begrijpen en om inspiratie te bieden voor de synthese van nieuwe materialen op kleibasis.
Bijdragen van auteurs
HC en QfL ontwierpen het experiment en herzagen het artikel. YZ, QhL, en PX deed de experimenten en schreef het papier. YZ en QhL gelijkelijk bijgedragen aan dit werk.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
Dr. Luyi Sun (Department of Chemical and Biomolecular Engineering and Polymer Program, Institute of Materials Science, University of Connecticut) wordt erkend voor het reviseren van het papier. De auteurs erkennen dankbaar de financiële steun van de National Natural Science Foundation of China (41602171), de Beijing Natural Science Foundation (8164062) en het Yue Qi Young Scholar Project, China University of Mining & Technology, Beijing.
Giese, R., and Datta, P. (1973). Hydroxyl orientation in kaolinite, dickite, and nacrite. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). Fourier Transform Infrarood Spectrometrie. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., and Guggenheim, S. (1985). Dehydroxylatie van kaoliniet. Am. Mineral. 70, 1-2.
Google Scholar
Geef een antwoord