Dipol – Dipolkräfte
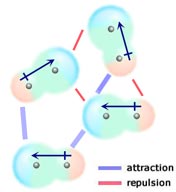
Wenn zwei neutrale Moleküle, die jeweils ein permanentes Dipolmoment haben, so zusammenkommen, dass ihre entgegengesetzt geladenen Enden sich ausrichten, werden sie voneinander angezogen. In einer Flüssigkeit oder einem Festkörper werden solche Ausrichtungen gegenüber solchen bevorzugt, bei denen die gleich geladenen Enden der Moleküle nahe beieinander liegen und sich daher gegenseitig abstoßen.
Ein Grund, warum CH3F einen höheren Siedepunkt (-84 °C) als CF4 (-128 °C) hat, ist, dass CF3H ein permanentes Dipolmoment hat, CF4 dagegen nicht. Um dies zu verstehen, muss man wissen, dass CF4 tetraedrisch und CH3F annähernd tetraedrisch ist (es gibt keinen großen Unterschied zwischen den Formen dieser Moleküle). Die Kohlenstoff-Fluor-Bindungen in beiden Molekülen sind polar (Fluor ist viel elektronegativer als Kohlenstoff), aber das Vorhandensein von vier C-F-Bindungen in dem tetraedrischen CF4-Molekül macht das Molekül insgesamt unpolar. Das Dipolmoment der einzelnen C-F-Bindung in CH3F wird durch die Dipole der C-H-Bindung (die sehr klein sind) nicht aufgehoben, so dass CH3F ein permanentes Dipolmoment hat.
Eine Art von intermolekularer Kraft, die unter bestimmten Umständen auftreten kann und gewöhnlich als Dipol-Dipol-Wechselwirkung klassifiziert wird, obwohl sie einen gewissen kovalenten Bindungscharakter hat, ist die Wasserstoffbrückenbindung.
Schreibe einen Kommentar