Warum ist bei der Reaktion mit Ammoniak Wasser die Säure?
Dies ist eine großartige Reaktion der allgemeinen Chemie mit wichtigen Auswirkungen auf die organische Chemie. Eine andere ähnliche Frage ist, warum ist Wasser eine Base, wenn es mit einer „Säure“ reagiert? Die Antwort auf beide Fragen lautet: Es ist alles relativ! Hier bei StudyOrgo erhalten wir häufig Fragen wie diese zu Themen in der organischen Chemie, die normalerweise schnell abgehandelt oder schlecht beschrieben werden oder von denen man erwartet, dass man sie aus früheren Kursen kennt. Diese Konzepte sind wirklich wichtig, um die komplexeren Themen zu verstehen, die folgen werden. Mit einer Mitgliedschaft bei StudyOrgo erhalten Sie noch mehr Tipps und Tricks zu Themen der organischen Chemie und detaillierte Mechanismen mit Erklärungen. Der heutige Blog ist eine Vorschau auf die detaillierten Themen und Materialien, die zur Verfügung stehen. Informieren Sie sich über eine Mitgliedschaft bei StudyOrgo.com und melden Sie sich noch heute an!
Erinnern Sie sich, dass es bei Säuren und Basen zwei Definitionen gibt: die Bronsted- und die Lewis-Definition. Bronsted-Säuren sind als Protonenspender definiert, während Lewis-Säuren als Elektronenakzeptoren definiert sind. Beide sind Säuren, aber der Unterschied liegt darin, ob Protonen oder Elektronen beteiligt sind. In einer wässrigen Lösung, in der allgemeinen Chemie oder in der Biochemie denken wir hauptsächlich an die Bronsted-Definition, weil die Dissoziation von Protonen aus Säuren die Konzentration von H+ in der Lösung verändert, was wir als Änderung des pH-Werts und des „Säuregrads“ der Lösung interpretieren. Wir messen die Dissoziation der Protonen von Säuren oder die Aufnahme von Protonen durch Basen mit einem numerischen Wert, dem pKa. Je größer der pKa-Wert ist, desto schwächer ist die Säure und desto stärker die Base. Je niedriger der pKa-Wert, desto stärker die Säure und desto schwächer die Base. Ein einfacher Trick, um sich den pKa zu vergegenwärtigen, besteht darin, die protonierte Version des Moleküls auf die linke Seite zu legen und sie sich als Protonendonator vorzustellen. Der pKa gibt an, wie leicht diese Spende sein wird, je niedriger die Zahl, desto leichter die Protonenspende.
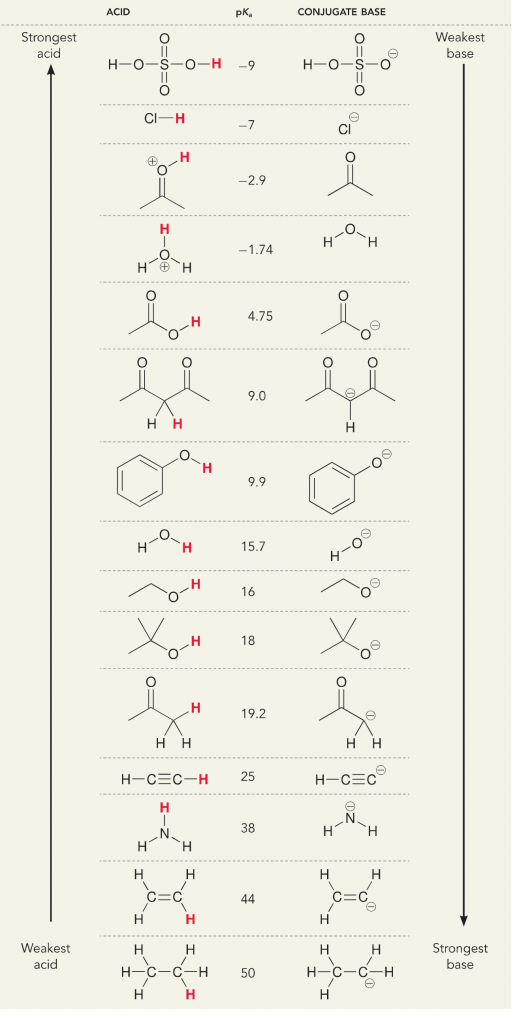
Betrachten wir die Reaktion von Ammoniak und Wasser; der pKa für Wasser ist mit 14 definiert. Der pKa von Ammoniak ist ~37.
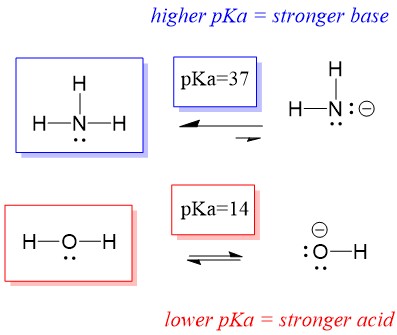
Da der pKa von Wasser niedriger ist als der von Ammoniak, ist es eine stärkere Säure als Ammoniak und spendet Protonen an die Ammoniakbase. Diese Reaktion führt dazu, dass Wasser zur konjugierten Base OH- und Ammoniak zur konjugierten Säure NH4+ wird. Interessanterweise ist dies der Grund, warum Ammoniak ein ätzendes Mittel ist: Es erzeugt Hydroxid, das mit Flecken und Mikroorganismen reagiert, um Haushaltsgegenstände wirksam zu reinigen und zu desinfizieren.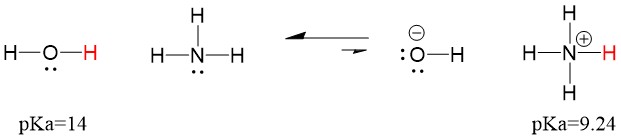
Dies ist als Konzept der organischen Chemie wichtig, weil die Stärke von Säuren und Basen in Bezug auf Elektronen oder die Lewis-Definition genau dem entspricht, wie wir über die Mechanismen von Bindungsbruch und Bindungsbildung denken: dem Elektronenfluss. Die Stärke der Lewis-Säuren und der konjugierten Säure kann dabei helfen, die Richtung einer Reaktion zu bestimmen. Wir können sehen, dass die Reaktion von Wasser und Ammoniak ungünstig ist, aber in der Realität findet genug von der Reaktion statt, um den pH-Wert von Wasser erheblich zu senken (pH~11 mit Ammoniak).
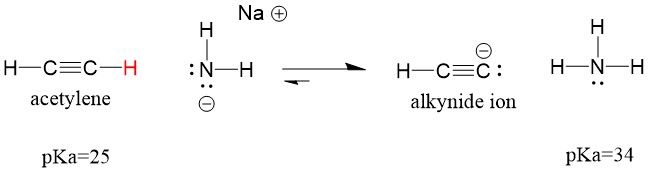
Betrachten wir ein Acetylen, das mit einer Base reagiert, um ein Alkynid-Ion zu erzeugen, ein nützliches Nukleophil für die Bildung von C-C-Bindungen. Wenn wir versuchen, Natriumhydroxid mit Alkin zu reagieren, wird das Alkinid-Ion NICHT gebildet werden. Das liegt daran, dass das konjugierte Säureprodukt der Reaktion Wasser ist, das einen pKa von 15 hat und damit STÄRKER ist als die ursprüngliche Säure Acetylen (pKa = 25). Reaktionen begünstigen IMMER die Bildung der schwächeren Säure, oder in diesem Fall der Reaktionspartner.
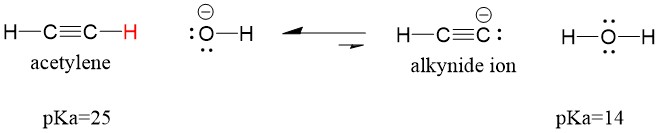
Wenn wir unsere Base durch Natriumamid ersetzen, das eine viel stärkere Base ist, WIRD das Alkynidion gebildet. Das liegt daran, dass das konjugierte Säureprodukt der Reaktion Ammoniak ist, das einen pKa von 38 hat und eine SCHWÄCHERE konjugierte Säure ist als die ursprüngliche Säure Acetylen (pKa = 25). In diesem Fall begünstigt die Reaktion die Produktseite!

Schreibe einen Kommentar