Die Verbrennung von Kohlenwasserstoffen ist eine chemische Reaktion, bei der ein Kohlenwasserstoff mit Sauerstoff reagiert und Kohlendioxid, Wasser und Wärme erzeugt. Kohlenwasserstoffe sind Moleküle, die sowohl aus Wasserstoff als auch aus Kohlenstoff bestehen. Am bekanntesten sind sie als Hauptbestandteil der fossilen Brennstoffe, nämlich Erdgas, Erdöl und Kohle. Aus diesem Grund werden fossile Brennstoffressourcen oft als Kohlenwasserstoffressourcen bezeichnet. Energie wird aus fossilen Brennstoffen durch Verbrennung des Brennstoffs gewonnen. Obwohl fossile Brennstoffe Verunreinigungen enthalten, ist die Verbrennung von Kohlenwasserstoffen der wichtigste Prozess bei der Verbrennung von fossilen Brennstoffen. Ein Beispiel für die Verbrennung von Kohlenwasserstoffen ist in Abbildung 1 dargestellt. Weitere Beispiele finden Sie in der Simulation am Ende der Seite.
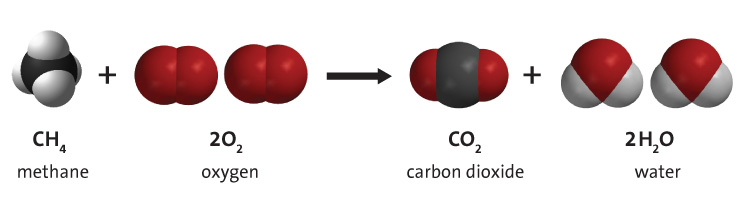
Beschreibung
Unabhängig von der Art des Kohlenwasserstoffs entstehen bei der Verbrennung mit Sauerstoff drei Produkte: Kohlendioxid, Wasser und Wärme, wie in der nachstehenden allgemeinen Reaktion dargestellt. Die zum Aufbrechen der Bindungen in den Kohlenwasserstoffmolekülen erforderliche Energie ist wesentlich geringer als die Energie, die bei der Bildung der Bindungen in den CO2- und H2O-Molekülen freigesetzt wird. Aus diesem Grund werden bei diesem Prozess erhebliche Mengen an thermischer Energie (Wärme) freigesetzt. Diese thermische Energie kann direkt genutzt werden (z. B. zum Heizen eines Hauses), oder sie kann mit Hilfe einer Wärmekraftmaschine in mechanische Energie umgewandelt werden. Dabei kommt es jedoch zu Wirkungsgradverlusten, die gemäß dem zweiten Hauptsatz der Thermodynamik zu erheblichen Energieverlusten (als Abwärme) führen. Die daraus resultierende nutzbare mechanische Energie ist wesentlich geringer als die ursprüngliche thermische Energie, die durch die Verbrennung der Kohlenwasserstoffe bereitgestellt wurde.
Allgemeine Reaktionsgleichung:
- bezieht sich auf die Anzahl der Kohlenstoffatome im Kohlenwasserstoff
- bezieht sich auf die Anzahl der Wasserstoffatome im Kohlenwasserstoff
- bezieht sich auf die Anzahl der Sauerstoffatome, die bei der Kohlenwasserstoffverbrennungsreaktion benötigt werden
Kohlenwasserstoffverbrennung und fossile Brennstoffe
Beachten Sie, dass bei der Kohlenwasserstoffverbrennung immer CO2 entsteht; es spielt keine Rolle, welche Art von Kohlenwasserstoffmolekül. Die Erzeugung von CO2 und H2O ist die eigentliche Art und Weise, wie aus fossilen Brennstoffen Nutzenergie gewonnen wird. Aus diesem Grund ist es wichtig, zwischen Kohlendioxid und anderen „Abfallprodukten“ zu unterscheiden, die durch Verunreinigungen im Brennstoff wie Schwefel- und Stickstoffverbindungen entstehen. Abfälle, die durch Verunreinigungen entstehen, können mit der richtigen Technologie beseitigt werden; CO2 kann nur dann beseitigt werden, wenn die fossilen Brennstoffe gar nicht erst verbrannt (verwendet) werden.
Nicht alle fossilen Brennstoffe haben die gleiche Zusammensetzung. Erdgas besteht zu über 90 % aus Methan (CH4), dem kleinsten Kohlenwasserstoffmolekül. Erdöl besteht in der Regel aus mittelgroßen Molekülen, obwohl die Zusammensetzung von einer Rohölsorte zur nächsten sehr unterschiedlich ist. Im Allgemeinen gilt: Je dichter das Öl ist, desto länger sind die Kohlenstoffketten in den Molekülen. Kohle schließlich enthält die größten und komplexesten Kohlenwasserstoffmoleküle.
Da die verschiedenen Kohlenwasserstoffe ein unterschiedliches Verhältnis von Wasserstoff zu Kohlenstoff aufweisen, erzeugen sie auch ein unterschiedliches Verhältnis von Wasser zu Kohlendioxid. Im Allgemeinen gilt: Je länger und komplexer das Molekül, desto größer ist das Verhältnis von Kohlenstoff zu Wasserstoff. Aus diesem Grund entstehen bei der Verbrennung gleicher Mengen verschiedener Kohlenwasserstoffe unterschiedliche Mengen an Kohlendioxid, je nach dem Verhältnis von Kohlenstoff zu Wasserstoff in den Molekülen der einzelnen Stoffe. Da Kohle die längsten und komplexesten Kohlenwasserstoffmoleküle enthält, wird bei der Verbrennung von Kohle mehr CO2 freigesetzt als bei der Verbrennung der gleichen Menge Erdöl oder Erdgas. Dadurch ändert sich auch die Energiedichte jedes dieser Brennstoffe.
Kohlendioxidemissionen
Nachfolgend ein Diagramm der CO2-Emissionen, die bei der Erzeugung von 293,1 kWh (1.000.000 BTUs) Energie aus verschiedenen Kohlenwasserstoffbrennstoffen entstehen.
| Brennstoff | kg CO2-Emissionen |
|---|---|
| Anthrazitkohle | 104 |
| Bituminöse Kohle | 93.5 |
| Braunkohle | 97.9 |
| Subbituminöse Kohle | 97.4 |
| Diesel | 73.2 |
| Benzin | 71.5 |
| Propan | 63.2 |
| Erdgas | 53.2 |
Verbrennungsanimation
Wählen Sie einen Brennstoff aus dem Dropdown-Menü, um die Nettoreaktion zu sehen, die bei der Verbrennung stattfindet.
Für weitere Lektüre
Weitere Informationen finden Sie auf den entsprechenden Seiten unten:
- Fossiler Brennstoff
- Primärenergie
- Kohlenwasserstoff
- Kohle
- Öl
- Erdgas
- Eine zufällige Seite
Schreibe einen Kommentar