Die Lewis-Struktur des Carbonat-Ions wird in diesem Tutorial Schritt für Schritt gezeichnet. Das Konzept der gesamten Valenzelektronen wird verwendet, um die Lewis-Struktur von CO32- zu zeichnen. Nach der Fertigstellung der Lewis-Struktur von CO32- sollte es eine -2-Ladung und eine Stabilität geben. Du wirst diese Dinge in diesem Tutorium lernen.
- Carbonat-Ion | CO32-
- CO32- Lewis-Struktur
- Schritte zum Zeichnen der Lewis-Struktur von CO32-
- Gesamtzahl der Elektronen der Valenzschalen von CO32-
- Gesamte Valenzelektronenpaare
- Zentralatom des CO32-Ions
- Einzelne Atompaare
- Ladungen auf den Atomen
- Prüfe die Stabilität und minimiere die Ladungen auf den Atomen, indem du einsame Paare in Bindungen umwandelst
- Lewis-Struktur des CO32- (Carbonat) Ions
- Lewis-Struktur von Carbonat und Bicarbonat
Carbonat-Ion | CO32-
Das Carbonat-Ion hat eine -2 Ladung. Metallcarbonatverbindungen sind in der Welt weit verbreitet. Als ein CaCO3 kann angegeben werden.
CO32- Lewis-Struktur
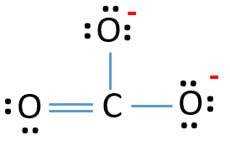
In der Lewis-Struktur des CO32- Ions gibt es drei σ-Bindungen und eine π-Bindung um das Kohlenstoffatom herum.
Schritte zum Zeichnen der Lewis-Struktur von CO32-
Zum Zeichnen der CO32- Lewis-Struktur sind folgende Schritte erforderlich, die in diesem Tutorium ausführlich erklärt werden.
- Gesamtzahl der Elektronen der Valanzschalen von Kohlenstoff- und Sauerstoffatomen ermitteln
- Gesamte Elektronenpaare
- Atom zentrieren
- Atome mit einsamen Paaren versehen
- Stabilität prüfen und Ladungen der Atome durch Umwandlung der einsamen Paare in Bindungen minimieren.
Das Zeichnen der korrekten Lewis-Struktur ist wichtig, um die Resonanzstrukturen von CO32- richtig zu zeichnen.
Gesamtzahl der Elektronen der Valenzschalen von CO32-
Kohlenstoff befindet sich in der Gruppe 4 des Periodensystems. Kohlenstoff hat also vier Elektronen in seiner Valenzschale.Sauerstoff befindet sich in der 6. Gruppe. Es hat sechs Elektronen in der Valenzschale.
- Gesamte Valenzelektronen des Kohlenstoffatoms = 4
Es gibt drei Sauerstoffatome im CO32- Ion, daher
- Gesamte Valenzelektronen des Sauerstoffatoms = 6 *3 = 18
Es gibt -2 Ladungen im CO32- Ion. Daher gibt es zwei weitere Elektronen, die zu den Valenzelektronen beitragen.
- Gesamte Valenzelektronen = 4 + 18 + 2 = 24
Gesamte Valenzelektronenpaare
Gesamte Valenzelektronenpaare = σ-Bindungen + π-Bindungen + einsame Paare in den Valenzschalen
Die Gesamtzahl der Elektronenpaare wird ermittelt, indem man die Gesamtzahl der Valenzelektronen durch zwei dividiert. Für das CO32-Ion beträgt die Gesamtzahl der Elektronenpaare 12.
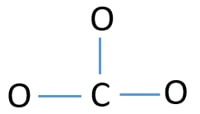
Zentralatom des CO32-Ions
Um das Zentralatom zu sein, ist die Fähigkeit, eine höhere Wertigkeit zu haben, wichtig. Kohlenstoff hat die größte Chance, das Zentralatom zu sein (siehe Abbildung), weil Kohlenstoff eine Wertigkeit von 4 aufweisen kann. Die höchste Wertigkeit von Sauerstoff ist 2. So, jetzt können wir eine Skizze des CO32- Ions erstellen.
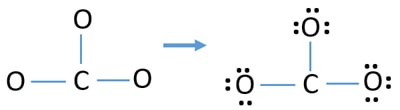
Einzelne Atompaare
- In der obigen Skizze gibt es bereits drei C-O-Bindungen. Es bleiben also nur noch neun (12-3 = 9) Valenzelektronenpaare übrig.
- Zunächst markiert man diese neun Valenzelektronenpaare als einsame Paare an Außenatomen (an Sauerstoffatomen). Ein Sauerstoffatom nimmt nach der Oktalregel (Sauerstoffatom kann nicht mehr als acht Elektronen in seiner Valenzschale behalten) drei einsame Paare auf.
- Bei drei Sauerstoffatomen sind neun Elektronenpaare verbraucht. Nach der Markierung der Sauerstoffatome (außerhalb der Atome) gibt es nun keine einsamen Elektronenpaare mehr auf den Kohlenstoffatomen zu markieren.
Ladungen auf den Atomen
Nach der Markierung der Elektronenpaare auf den Atomen sollten wir die Ladungen der einzelnen Atome markieren. Die Markierung der Ladungen ist wichtig, weil sie zur Bestimmung der besten Lewis-Struktur des Ions verwendet wird. Nach der Markierung der Ladungen wird man sehen, dass jedes Sauerstoffatom eine -1 Ladung und jedes Kohlenstoffatom eine +1 Ladung erhält.
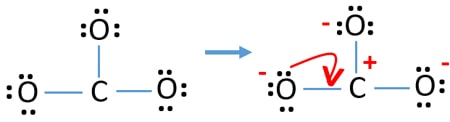
Prüfe die Stabilität und minimiere die Ladungen auf den Atomen, indem du einsame Paare in Bindungen umwandelst
- Sauerstoffatome sollten negative Ladungen tragen, weil die Elektronegativität des Sauerstoffatoms höher ist als die des Kohlenstoffatoms. Andernfalls können wir sagen, dass die Fähigkeit, negative Ladungen zu halten, bei Sauerstoffatomen größer ist als bei Kohlenstoffatomen.
- Die gezeichnete Struktur ist nicht stabil, weil alle Atome eine Ladung haben (die Lewis-Struktur sollte eine stabile Struktur mit weniger Ladungen sein).
- Nun sollten wir versuchen, Ladungen zu minimieren, indem wir einsame Paare in Bindungen umwandeln. Also ein einsames Paar eines Sauerstoffatoms in eine C-O-Bindung umwandeln.
- Jetzt gibt es eine Doppelbindung zwischen dem Kohlenstoffatom und einem Sauerstoffatom (eine C=O-Bindung). Jetzt gibt es zwei Einfachbindungen zwischen dem Kohlenstoffatom und den beiden anderen Sauerstoffatomen (zwei C-O-Bindungen).
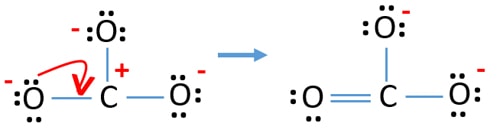
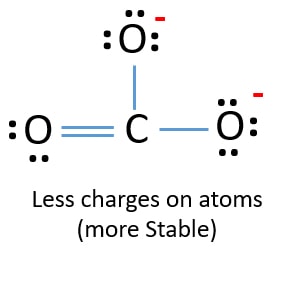
In der neuen Struktur sind die Ladungen der Atome geringer als in der vorherigen Struktur. Ein Sauerstoffatom und das Kohlenstoffatom sind jetzt nicht mehr geladen. Außerdem haben nur zwei Sauerstoffatome -1 negative Ladung. Du verstehst jetzt, dass diese Struktur von CO32- stabiler ist als die vorherige Struktur. Daher hat diese Struktur eine größere Chance, die Lewis-Struktur des CO32–Ions zu sein.
Lewis-Struktur des CO32- (Carbonat) Ions
Fragen
Fragen Sie Ihre Chemie und finden Sie die Antworten
Lewis-Struktur von Carbonat und Bicarbonat
Im Carbonat-Ion gibt es zwei Sauerstoffatome, die jeweils -1 Ladung haben. Eines dieser Sauerstoffatome nimmt ein Proton (H+-Ion) auf und bildet eine -OH-Gruppe.
Verwandte Tutorials
Schreibe einen Kommentar