Ergebnisse
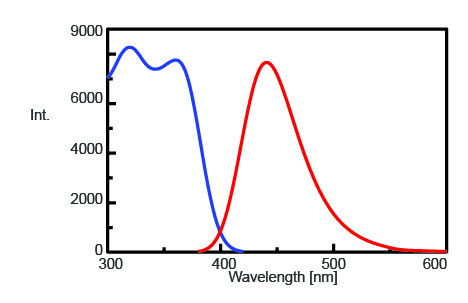
Um die maximale Emissionswellenlänge zur Überwachung der Fluoreszenzintensität von AMC nach der Trypsinspaltung zu ermitteln, wurden die Anregungs- und Emissionsspektren gemessen und sind in Abbildung 1 dargestellt. Die maximale Emissionswellenlänge liegt bei 440 nm.
Um die gemessene Fluoreszenzintensität der Enzymlösung auf die Konzentration des isolierten AMC zu standardisieren, wurde eine Titration durchgeführt und die Fluoreszenz gemessen. 0,5 mL Aliquots einer 50 µmol/L AMC-Lösung wurden zu einer 2,5 mL Enzymlösung hinzugefügt, und die Anfangs- und Endkonzentrationen des isolierten AMC sind in Tabelle 1 zusammengefasst.
Tabelle 1. Isolierte AMC-Konzentrationen vor und nach der Standardisierung der Fluoreszenzintensität.
| Anfangskonzentration | 3 | 6 | 15 | 30 | 60 | 120 | 240 |
| Endkonzentration | 0.5 | 1 | 2.5 | 5 | 10 | 20 | 40 |
Die Kinetik der Trypsinaktivität wurde dann durch Messung der Fluoreszenzintensität von isoliertem AMC nach der Spaltung von Trypsin vom Substrat ermittelt. Abbildung 2 zeigt die Zeitverlaufsmessung, nachdem 0,5 mL unterschiedlicher Konzentrationen der Boc-Gln-Ala-Arg-MCA-Substratlösung zu 2,5 mL der Enzymlösung hinzugefügt wurden.
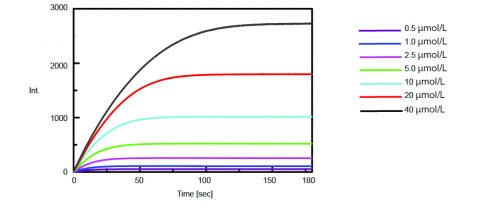
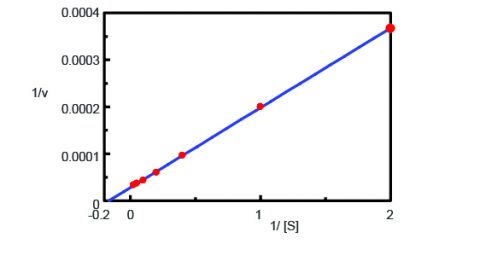
Mit dem Programm Kinetics Analysis wurde aus den Fluoreszenzzeitverlaufsmessungen in Abbildung 2 ein Lineweaver-Burk-Diagramm (Abbildung 3) erstellt. Das Lineweaver-Burk-Diagramm liefert enzymkinetische Parameter wie die maximale Reaktionsgeschwindigkeit, Vmax, und die Michaelis-Menten-Konstante, Km. Vmax beschreibt die Reaktionsgeschwindigkeit, wenn das Enzym mit Substrat gesättigt ist, während Km die Menge an Substrat angibt, mit der die maximale Reaktionsgeschwindigkeit erreicht wird. Vmax war 35.270 nmol/L-min-1 und Km war 5,99. Die Gleichung der Linie war 1/v = 0,000270 – 1/ + 0,0000284.
Schreibe einen Kommentar