- Introduction
- Experimentelles
- Materialien
- Synthese der Interkalationsverbindungen
- Charakterisierung
- Ergebnisse und Diskussion
- XRD-Charakterisierung
- FTIR-Spektren
- Strukturmodell von Kaol/Alkylamin-Interkalationsverbindungen
- Thermische Analyse
- Zersetzungsreaktionskinetik
- Schlussfolgerungen
- Beiträge der Autoren
- Erklärung zu Interessenkonflikten
- Danksagungen
Introduction
Die Entwicklung und Herstellung von Ton-/Polymer-Nanokompositen ist sowohl in der Wissenschaft als auch in der Technik auf großes Interesse gestoßen (Cheng et al., 2017). Es wurde eine Vielzahl von Ton/Polymer-Nanokompositen entwickelt, die in zahlreichen Anwendungen eingesetzt werden (Gogoi und Raidongia, 2017). Die Vorinterkalierung von Tonen und die anschließende Einbindung von Polymeren in die Tonmineralschicht ist ein weit verbreiteter Ansatz für die Herstellung von Ton/Polymer-Nanokompositen (Li et al., 2009; Zare et al., 2017). Während sie in anorganische Tonschichten interkaliert werden, verringern organische Polymerketten natürlich ihre strukturelle Mobilität und einige von ihnen nehmen eine hoch organisierte Konformation innerhalb der Schichtstruktur an.
In der Natur ist Kaolinit (Kaol) eine Art von Tonmineral mit einer 1:1 dioktaedrischen Aluminiumsilikat-Schichtstruktur (Brindley und Robinson, 1945). Die Schichten in Kaol werden durch Wasserstoffbrücken, Dipol-Dipol-Wechselwirkungen und van der Waals-Kräfte zusammengehalten (Brindley et al., 1967). Allerdings wurde nur eine begrenzte Anzahl hochpolarer organischer Stoffe wie Harnstoff (Makó et al., 2009), Dimethylsulfoxid (Costanzo und Giesse, 1986), Formamid (Frost et al., 2000a), Hydrazin (Cruz und Franco, 2000) und Kaliumacetat (Frost et al., 2000b) erfolgreich in die Kaol-Galerie interkaliert. Die Einlagerung kleiner Moleküle in Kaol-Schichten führt zu einer Vergrößerung des Basalabstands und kann als vorbereitender Expansionsschritt für die anschließende Einlagerung großer, nicht reaktiver Spezies durch die Verdrängung der zuvor eingelagerten kleinen Moleküle verwendet werden (Cheng et al., 2015). Aus früheren Berichten geht beispielsweise hervor, dass eine Kaol/Methanol-Interkalationsverbindung ein effektives Zwischenprodukt für weitere Interkalationsreaktionen mit Ethylenglykol (Hirsemann et al., 2011), Hexylamin (Matusik et al., 2012), n-Alkylaminen (Gardolinski und Lagaly, 2005) und quaternären Ammoniumsalzen (Cheng et al., 2016) sein kann. Darüber hinaus ist es für die meisten Gastmoleküle schwierig, sich in den Zwischenschichtraum einzufügen, was zum einen an den starken Wasserstoffbrückenbindungen liegt und zum anderen daran, dass es in der Kaol-Struktur keine austauschbaren Ionen gibt.
Obwohl Ton/Polymer-Nanokomposite in den letzten Jahren gut entwickelt wurden, stellt die Synthese neuer Ton/organischer Nanokomposite für potenzielle Anwendungen immer noch eine große Herausforderung dar (Kotal und Bhowmick, 2015). Um dieses Problem zu lösen, ist es dringend erforderlich, den Prozess der Kaoliniteinlagerung im Nanomaßstab zu verstehen und den Mechanismus der Zersetzung mit modernen Technologien und Analysewerkzeugen gründlich zu untersuchen. Thermische Analysen und kinetische Berechnungen von Ton-Polymer-Interkalationsverbindungen können dazu beitragen, die Zersetzungsprozesse zu charakterisieren und eine wissenschaftliche Grundlage für die Kontrolle der Interkalationsreaktionen zu schaffen (Zhang et al., 2015). Die kinetischen Parameter der Zersetzungsreaktionskinetik, wie Aktivierungsenergie, Präexponential, Reaktionsordnungen und Geschwindigkeitskonstante, wurden anhand der Daten aus den Ton/Polymer-Thermogrammen bewertet. In dieser Studie wurde die Interkalation von Kaol mit verschiedenen Alkylaminen untersucht. Außerdem wurden der Interkalationsprozess und der Zersetzungsmechanismus systematisch untersucht.
Experimentelles
Materialien
Das in dieser Studie verwendete Kaolin wurde aus Zhangjiakou, China, gewonnen. Die Hauptmineralzusammensetzung ist ein gut geordneter Kaolinit (95 % der Masse). Es wurde vor der Einlagerung so gemahlen, dass es ein 325-Maschen-Sieb passiert (Partikel mit einer Größe von < 44 μm). Alkylamin Hexylamin (HA, 99%), Dodecylamin (DA, chemisch rein) und Octadecylamin (OA, chemisch rein) wurden von Nanjing Shuguang Chemical Company, China, bezogen. Dimethylsulfoxid (DMSO, Analytisches Reagenz), Methanol (MeOH, Analytisches Reagenz) und Toluol (99%) wurden von der Xilong Chemical Company, China, bezogen und ohne weitere Reinigung verwendet. Die chemische Formel und die Strukturformel von HA, DA und OA sind in Tabelle 1 angegeben.

Table 1. Chemische und strukturelle Formeln von HA, DA und OA.
Synthese der Interkalationsverbindungen
Zunächst wurde die Kaol/DMSO-Interkalationsverbindung durch Dispergieren von 20,0 g Kaol in einer Mischung aus 36,0 g DMSO und 4,0 g Wasser hergestellt. Das Gemisch wurde 2 Stunden lang bei 95 °C im Wasserbad gerührt, und anschließend wurde die Suspension durch Zentrifugieren mit Ethanol abgetrennt. Anschließend wurde die Kaol/DMSO-Interkalationsverbindung als Vorstufe für die weitere Reaktion mit MeOH verwendet. Das MeOH wurde dem vorinterkalierten Kaol zugesetzt, und das Reaktionsgemisch wurde 10 Tage lang gerührt, wobei das MeOH jeden Tag durch die gleiche Menge an frischem MeOH ersetzt wurde. Der Niederschlag in der Mischung wurde durch Zentrifugieren abgetrennt und 12 Stunden lang bei 60 °C im Ofen getrocknet, um Kaol/MeOH-Interkalationsverbindungen zu erhalten. Schließlich wurden 2 g Kaol/MeOH-Interkalationsverbindung mit 30,0 mL HA-, DA- bzw. OA-Methanollösungen (1 mol/L) unter Rühren bei Raumtemperatur vermischt. Die Dispersionen wurden nach der Reaktion 24 Stunden lang zentrifugiert. Die Sedimente wurden dreimal mit Toluol gewaschen, um überschüssiges HA, DA oder OA zu entfernen. Die Proben wurden 12 Stunden lang bei Raumtemperatur getrocknet und mit einem Achatmörser zu Pulver vermahlen (Komori et al., 1999). Die resultierenden Verbindungen werden als Kaolpi/HA (pi als vorinterkaliert), Kaolpi/DA und Kaolpi/OA bezeichnet.
Charakterisierung
Die XRD-Muster wurden mit einem Rigaku D/max 2500PC Röntgendiffraktometer mit Cu Kα (λ = 1,54178 Å) Strahlung bei 40 kV und 150 mA aufgenommen. Die zufällig orientierten Proben wurden im 2θ-Bereich zwischen 1 und 20° mit einer Geschwindigkeit von 2° min-1 gescannt. Mit einem Thermo Fisher Nicolet 6700 Spektrophotometer wurden die FTIR-Spektren im Bereich von 4.000 bis 400 cm-1 aufgezeichnet. Die TG-DSC-Analysen wurden mit einem Mettler-Toledo TG-DSC I/1600 HT Simultan-Thermoanalysator unter Stickstoffatmosphäre durchgeführt. Zwanzig Milligramm der Probe wurden in einen Aluminiumoxid-Tiegel gegeben und von 30 auf 1.100°C mit einer Reihe von Heizraten von 4, 6, 8, 10°C min-1 erhitzt.
Ergebnisse und Diskussion
XRD-Charakterisierung
Die XRD-Muster des reinen Kaols und seiner Interkalationsverbindungen sind in Abbildung 1 dargestellt. Das Muster des unberührten Kaol zeigt eine gut geordnete Schichtstruktur mit einem Basalabstand von 0,71 nm. Dieser Wert stimmt gut mit dem Standard-ICDD-Referenzmuster 14-0164 überein. Nach der Behandlung mit DMSO erschien ein neuer basaler Reflexionspeak bei 1,14 nm, was darauf hinweist, dass DMSO erfolgreich in die Kaol-Zwischenschichten eingebracht wurde. Nachdem die Kaol/DMSO-Interkalationsverbindung mit MeOH behandelt wurde, verschob sich die für die Kaol/DMSO-Interkalationsverbindung charakteristische Reflexion bei 1,14 nm (001) auf 0,86 nm. Matusik et al. (2012) berichteten, dass die Kaol/DMSO/MeOH-Verbindung bei 110 °C getrocknet wurde, die Reflexion mit d = 1,12 nm verschwand und eine breite Reflexion mit einem Maximum bei 0,95 nm beobachtet wurde. Basierend auf der chemischen Formel Al2Si2O5(OH)3.20(OCH3)0.80 der Kaol/DMSO-Interkalationsverbindung, die auf der Grundlage der CHNS-Analyse berechnet wurde, zeigte sich, dass etwa 1/3 der inneren Oberflächen-OH-Gruppen durch Methoxygruppen ersetzt wurden, und diese Beobachtung deutet ebenfalls auf die Bildung einer Kaol/MeOH-Interkalationsverbindung hin (Tunney und Detellier, 1996; Cheng et al., 2015). Die XRD-Muster zeigen auch, dass die mit HA, DA und OA interkalierten Kaol/MeOH-Verbindungen die Struktur entlang der c-Achse erweitern, was zu einem großen Zwischenschichtabstand von 2,86, 4,08 bzw. 5,66 nm führt. Die Länge der HA-, DA- und OA-Molekülketten beträgt 1,56, 2,51 bzw. 3,65 nm (McNulty et al., 2011, 2014). Insgesamt nahm der Zwischenschichtabstand der Kaol/Alkylamin-Interkalationsverbindungen mit der Alkylkettenlänge der Alkylamine zu, aber das Alkylaminmolekül ist keine Einschicht- oder Doppelschichtstruktur, die senkrecht zur Kaol-Oberfläche steht.
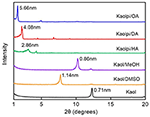
Abbildung 1. XRD-Muster von Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA und Kaolpi/OA.
FTIR-Spektren
FTIR-Spektroskopie wird häufig zur Charakterisierung von Interkalationsverbindungen verwendet (Ledoux und White, 1964; Frost et al., 2000c; Cheng et al., 2012). Die FTIR-Spektren der ursprünglichen Kaol-, Kaolpi/HA-, Kaolpi/DA- und Kaolpi/OA-Interkalationsverbindungen sind in Abbildung 2 dargestellt. Die charakteristischen Banden bei 432, 470 und 541 cm-1 (Abbildung 2B) gehören zum Deformationsmodus von Si-O, Si-O-Si und Al-O-Si. Die anderen Banden bei 1.009, 1.031 und 1.114 cm-1 (Abbildung 2C) werden den Streckschwingungen von Si-O-Si in der Kaol-Schicht zugeordnet. Vergleicht man die Spektren von Kaol und seinen Einlagerungsverbindungen, so zeigt die Position der Banden keine offensichtliche Veränderung, was darauf hindeutet, dass diese Streckschwingungsbanden nicht von den eingelagerten Molekülen beeinflusst werden.
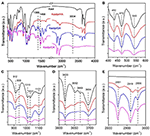
Abbildung 2. Infrarotspektren von Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Die Banden bei 912 und 938 cm-1 (Abbildung 2C) gehören zu den OH-Verformungen der inneren Hydroxylgruppen und der Hydroxylgruppen an der inneren Oberfläche. Es gibt vier offensichtliche Hydroxyl-Streckbanden bei 3.694, 3.669, 3.652 und 3.620 cm-1 (Abbildung 2D) im Spektrum des ursprünglichen Kaol, wobei die Banden bei 3.694, 3.669 und 3.652 cm-1 von den Hydroxylgruppen der inneren Oberfläche verursacht werden, während die Bande bei 3.620 cm-1 von den inneren Hydroxylgruppen herrührt (Farmer, 1964; Ledoux und White, 1964; Giese und Datta, 1973). Nach der Interkalation von Alkylaminmolekülen wurden einige Banden aufgrund der veränderten Wechselwirkungen mit benachbarten Atomen geschwächt. Die Verschiebung zu 3.697 cm-1 und die Abnahme der Intensität der Bande bei 3.694 cm-1 deutet darauf hin, dass zahlreiche Hydroxylgruppen in Kaol beteiligt waren und Wasserstoffbrückenbindungen mit den Amingruppen in den Alkylaminmolekülen bildeten (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
Das Vorhandensein von Zwischenschicht-Alkylaminmolekülen wurde im FTIR-Spektrum durch die neuen Peaks nachgewiesen, die in den Abbildungen 2A und E dargestellt sind. Bei den Interkalationsverbindungen gehören einige offensichtliche charakteristische Peaks, wie die Bande bei 1.388 und 1.468 cm-1, zum C-H-Biegemodus von -CH3 bzw. -CH2. Eine neue Schwingungsbande bei 3.334 cm-1 wurde beobachtet, die auf den Streckmodus der N-H-Streckschwingung zurückzuführen ist (Griffiths und De Haseth, 2007; Zhang et al., 2018). Die neue Schwingungsbande bei 2.956 cm-1 wurde beobachtet und wird normalerweise der asymmetrischen C-H-Streckungsbande der terminalen Methylgruppen zugeordnet (Cheng et al., 2016). Die beiden Schwingungsbanden bei 2.919 und 2.851 cm-1 werden normalerweise den symmetrischen und asymmetrischen Streckschwingungen der -(CH2)n- zugeordnet (Venkataraman und Vasudevan, 2001). Die Intensität der Banden nimmt allmählich zu, was bedeutet, dass mehr Alkylamin-Kohlenstoffatome in die Kaol-Zwischenschichten eingefügt worden sind. Außerdem nimmt die Flüchtigkeit von Alkylaminen mit zunehmender Kohlenstoffkette ab, so dass die Stabilität der entsprechenden Kaol-Interkalationsverbindungen mit zunehmender Molekülmasse des Alkylamins allmählich zunimmt (Wang et al., 2010).
Strukturmodell von Kaol/Alkylamin-Interkalationsverbindungen
Die Anordnung der interkalierten Moleküle ist die Grundlage für die experimentelle Analyse der Struktur der Kaol/Alkylamin-Interkalationsverbindung. Nach Lagaly (1981) lassen sich die Strukturmodelle der Montmorillonit-quaternären Ammoniumsalz-Interkalationsverbindungen in drei Kategorien einteilen: (a) Monoschichten: kurzkettige Alkylamin-Ionen; (b) Doppelschichten: langkettige quaternäre Ammonium-Ionen; (c) Dreischichten: geknickte Alkylketten in hochgeladenen Tonmineralen. Beneke und Lagaly (1982) schlugen darüber hinaus verschiedene Strukturen der interkalierten Alkylaminmoleküle vor, die auf dem XRD basieren und wie folgt zusammengefasst werden können: (a) die Alkylketten im Zwischenschichtraum sind zur (001)-Kristallebene geneigt; (b) die Alkylketten sind in Doppelschichten angeordnet. Brindley und Moll (1965) beschrieben, dass die interkalierten Moleküle zu den Silikatplatten in einer einzelnen Schicht geneigt sind, während der Winkel zur (001)-Kristallebene etwa 65° beträgt. Wenn die wechselwirkenden Moleküle durch die aktiven Hydroxylgruppen gleichmäßig an alle Silikatoberflächen gebunden sind, wird eine paarweise „end to end“-Organisation mit einer gewissen Längsverschiebung vorgeschlagen. Der Neigungswinkel steht im Einklang mit der möglichen engen Packung zwischen den Silikatsauerstoffoberflächen und den endständigen Hydroxylgruppen und dem Grad der engen Packung der Kettenmoleküle untereinander.
Die Alkylmoleküle lassen sich nur schwer direkt in die ursprünglichen Kaol-Schichten einlagern, da es an austauschbaren Ionen im Kaol-Zwischenraum fehlt. Für die Einlagerung der Alkylaminmoleküle in die Kaol-Zwischenschichten sind geeignete Vorläufer notwendig. Es wurde berichtet, dass die Alkyltrimethylammoniumchlorid-Kette eine gekippte Doppelschicht in der Zwischenschicht von Kaol bildet und der Kippwinkel nach der Berechnung ~36° beträgt (Kuroda et al., 2011). Yuan et al. (2013) wiesen darauf hin, dass die strukturelle Anordnung der quaternären Ammoniumsalzmoleküle in der Zwischenschicht von Kaol eine gekippte Doppelschicht bildet und der Kippwinkel ~38,4° beträgt. Gardolinski und Lagaly (2005) schlugen vor, dass die Alkylketten in den Zwischenschichten vollständig gestreckt und senkrecht zur Kaol-Oberfläche durch die Doppelschicht ausgerichtet sind. Aus der Analyse der Kettenlänge der HA-, DA- und OA-Moleküle kann daher die Schlussfolgerung gezogen werden, dass der Basalabstand nach der Interkalation nicht ausreicht, um den Eintritt der Alkylketten in die Kaol-Oberfläche in vertikaler und zweischichtiger Weise zu ermöglichen. Die weitere Analyse der XRD-Ergebnisse zeigt, dass die Alkylketten von HA, DA und OA in der Doppelschicht zur Kaol-Oberfläche geneigt sind und der Neigungswinkel der Alkylketten etwa 39,9, 39,9 bzw. 41,1° beträgt. Aufgrund der Hydroxylbindung zwischen dem Hydroxyl der inneren Oberfläche von Kaol und den Aminogruppen in den Alkylaminmolekülen ist das möglichste Strukturmodell für die Kaol/Alkylamin-Interkalationsverbindungen in Abbildung 3 dargestellt.
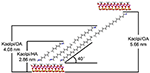
Abbildung 3. Das höchstmögliche Strukturmodell für die Kaolinit/Alkylamin-Interkalationsverbindungen.
Thermische Analyse
Die TG-DSC-Analyseergebnisse von Kaol und seinen Interkalationsverbindungen sind in Abbildung 4 dargestellt. Der Hauptmassenverlust von Kaol liegt zwischen 400 und 600 °C, wobei die maximale Verlustrate bei 525 °C auf den Verlust von Wasser aufgrund der Dehydroxylierung des Kristallgitters zurückzuführen ist, was zur Bildung von Meta-Kaolinit führt (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Dieser Verlust entspricht etwa 12,7 % der Gesamtmasse, was dem theoretischen Referenzwert (13,9 %) sehr nahe kommt. Vergleicht man die TG-DSC-Kurven des ursprünglichen Kaol, so lassen sich bei den Interkalationsverbindungen Kaolpi/HA, Kaolpi/DA und Kaolpi/OA zwei Hauptmasseverluststufen beobachten. Der erste tritt zwischen 150 und 350 °C auf, was auf die Zersetzung der interkalierten Alkylaminmoleküle zurückzuführen ist (Yuan et al., 2013). Die zweite tritt bei etwa 500 °C auf und ist auf die Dehydroxylierung des de-interkalierten Kaol zurückzuführen. Bei Kaolpi/OA wurden einige OA in den Silikat-Zwischenschichtraum interkaliert, um eine stabile Interkalation zu bilden, was durch das XRD-Muster nachgewiesen werden kann. Einige Moleküle sind aufgrund der langen Kette oder einer Klammer in den Nanorollen ineinander verschlungen und können nicht vollständig entfernt werden (Li et al., 2015; Liu et al., 2016). Bei 220 °C ist der deutliche Massenverlust auf die Zersetzung des beschichteten oder nicht gebundenen OA zurückzuführen, während der Massenverlust bei 330 °C auf die Zersetzung des interkalierten OA zurückzuführen ist. Der exotherme Peak bei 996°C ist auf die Rekristallisation von Kaol zurückzuführen.
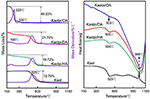
Abbildung 4. TG-DSC-Kurven für Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Beim Vergleich der TG-DSC-Kurven des ursprünglichen Kaol und der Kaol/Alkylamin-Interkalationsverbindungen (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA) kann man feststellen: (a) es gibt unterschiedliche Massenverluststufen sowie einen signifikanten Unterschied in den Massenverlusten zwischen Kaolpi/OA und den beiden anderen Interkalationsverbindungen (Kaolpi/HA, Kaolpi/DA). Die Massenverluste bei der Zersetzung von Kaolpi/HA und Kaolpi/DA betrugen etwa 20 %, während die Summe der beiden Massenverluste bei Kaolpi/OA etwa 50 % beträgt. Dies könnte darauf zurückzuführen sein, dass eine größere Menge an OA in den Silikat-Zwischenschichtraum interkaliert wurde als HA und DA (Wang et al., 2017). (b) Die Dehydroxylierungstemperatur der interkalierten Verbindungen war um etwa 20 °C niedriger als die des ursprünglichen Kaol. Dies ist darauf zurückzuführen, dass die Interkalationsmoleküle den Zwischenschichtabstand vergrößerten, die Wasserstoffbrücken zwischen den Kaol-Schichten schwächten und so eine leichtere Dehydroxylierung von der Kaol-Oberfläche bewirkten. Daher nahm die Kristallinität von Kaol nach der Interkalation stark ab, was durch XRD und IR (unter 800 cm-1) bestätigt werden kann. Dieses Ergebnis stimmt mit der Schlussfolgerung einiger anderer Berichte überein, dass die Temperatur der Dehydroxylierung durch die Kristallinität von Kaol bestimmt wurde (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Zersetzungsreaktionskinetik
Die Abbaukinetik der Kaol/Alkylamin-Interkalationsverbindung wurde mit Thermogravimetrietechniken untersucht. Die kinetischen Parameter (Aktivierungsenergie E und der präexponentielle Faktor A) des Abbauprozesses wurden auf der Grundlage der KAS- und Ozawa-Methode (Kissinger, 1957; Škvára und Šesták, 1975) berechnet. Der thermische Abbaumechanismus der Kaol/Alkylamin-Interkalationsverbindung wurde mit der Satava-Integralmethode untersucht (Xie et al., 2001; Gao et al., 2005; Zhang et al, 2015).
Nach der Reaktionstheorie wird die nicht-isotherme kinetische Zersetzungsformel in der Regel wie folgt ausgedrückt:
wobei α das Ausmaß der Umwandlungsrate von B(s) zum Zeitpunkt t, f (α) die Reaktionsmechanismusfunktion und k die Reaktionsgeschwindigkeitskonstante ist. k gehorcht der folgenden Gleichung:
Wenn die Temperatur der Probe mit einer konstanten Heizrate (β = dT/dt) gesteuert wird, kann die Reaktionsgeschwindigkeit wie folgt definiert werden:
Nach dem Trennen der Variablen, dem Umordnen mit Integral- oder Differentialfunktionen von Gleichung (4), können KAS-Gleichung (5) und Ozawa-Gleichung (6) wie folgt berechnet werden:
Wobei G(α) die Integralfunktion der Umrechnung darstellt. Wegen der integralen Annäherung wurden iterative Methoden zur Berechnung von E verwendet, um gewisse Abweichungen zu vermeiden. Die Funktionen der iterativen Methoden sind wie folgt:
Setzen Sie x = E/RT, die Definition von h(x) und H(x) sind:
Die Iteration besteht aus den folgenden drei Schritten:
(a) Man setzt h(x) = 1 oder H(x) = 1, berechnet E0 nach der Methode der kleinsten Quadrate entsprechend der Steigung der linearen Beziehung lnβ/T2 und lnβ zu 1/T.
(c) Ersetze E0 durch E1, wiederhole Schritt (b) bis Ei-Ei-1 < 0. 1 kJ mol-1. Ei ist der genaue Wert der Aktivierungsenergie der Zersetzungsreaktion.
Die E-Werte der Kaol/Alkylamin-Interkalationsverbindungen wurden mit Hilfe der KAS-, Ozawa- und Iterationsmethoden berechnet (Tabelle 2). Die mit der KAS-Methode berechneten Ergebnisse lagen näher an den Ergebnissen der iterativen Methoden, die Ergebnisse der iterativen Ozawa-Methode wichen jedoch stärker von den anderen ab. Daher kann das durchschnittliche E der iterativen Methoden als Aktivierungsenergie der Zersetzungsreaktion angesehen werden, da sie eine Verbesserung gegenüber den KAS- und Ozawa-Methoden darstellen. Das durchschnittliche E von Kaolpi/HA, Kaolpi/DA und Kaolpi/OA beträgt 104,44, 130,80 und 154,59 kJ mol-1. Es ist zu erkennen, dass die durchschnittlichen E der Kaol/Alkylamin-Verbindungen positiv mit der Länge der Alkylkette korrelieren. Einer der Gründe dafür ist, dass die Flüchtigkeit mit zunehmender Alkylkette abnimmt. Ein weiterer Grund ist, dass Kaolpi/OA die am besten geordnete Interkalationsstruktur besitzt, die am schwierigsten zu de-interkalieren ist. Und diese Ergebnisse können durch XRD-Muster bestätigt werden.
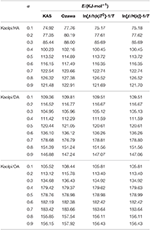
Tabelle 2. E von Kaol/Alkylamin-Interkalationsverbindungen mit verschiedenen α, berechnet durch KAS-, Ozawa- und Iterationsmethoden.
Die Funktionen und A des Zersetzungsreaktionsmechanismus wurden durch Satava-Methoden berechnet, die wie folgt beschrieben wurden:
Setzen Sie α in jede Mechanismusfunktion G(α) ein, um den Wert von lg, die lineare Anpassung lg und 1/T zu erhalten, die der Erhitzungsrate entsprechen, die Funktion, die die größte Anpassung hat, kann als die wahrscheinlichste Mechanismusfunktion bestimmt werden. Und die Werte von E und A können durch die Steigung und den Achsenabschnitt einer linearen Anpassungskurve erhalten werden.
Wie in Tabelle 3 gezeigt, werden fünf Mechanismusfunktionen mit einer Anpassungsgüte von über 90% auf der Grundlage der Satava-Integralformel ausgewählt. Durch den Vergleich dieser fünf Funktionen kann die Mechanismusfunktion Nr. 9 G(α) = 2 mit einer Anpassungsgüte von etwa 97 % als die wahrscheinlichste Mechanismusfunktion angesehen werden, und die linearen Anpassungskurven der Funktion Nr. 9 sind in Abbildung 5 dargestellt. E und A liegen ebenfalls im normalen Bereich der Zersetzungskinetik. Die Zersetzungsmechanismusfunktionen für die drei Kaol/Alkylamin-Interkalationsverbindungen sind in Tabelle 4 angegeben.

Table 3. Ausgewählte kinetische Mechanismusfunktionen, beurteilt nach der Satava-Integralmethode.

Abbildung 5. Lineare Anpassungskurven der Funktion Nr. 9, beurteilt mit der Satava-Integral-Methode.

Tabelle 4. Kinetische Mechanismusfunktionen von Kaol/Alkylamin-Interkalationsverbindungen.
Schlussfolgerungen
Die möglichen Strukturmodelle und die Zersetzungskinetik für Kaol/Alkylamin-Interkalationsverbindungen wurden mit XRD, FT-IR und TG-DSC untersucht. Die Interkalation von Kaol/MeOH-Verbindungen mit HA, DA und OA vergrößert den Zwischenschichtabstand von Kaol entlang der c-Achse, was dazu führt, dass die dominante Reflexion bei 2,86, 4,08 bzw. 5,66 nm auftritt. Darüber hinaus ist der Basalabstand nach der Interkalation nicht ausreichend, um das Eindringen der Alkylketten in vertikaler Einzel- und Doppelschichtform zu ermöglichen. Daraus wurde geschlossen, dass die Alkylketten von HA, DA und OA zur Kaol-Oberfläche in der Doppelschicht geneigt sind und der Neigungswinkel der Alkylketten ~40° beträgt.
Basierend auf den KAS-, Ozawa- und iterativen Methoden wurden die Ergebnisse der Aktivierungsenergie E der Kaol/Alkylamin-Interkalationsverbindungen berechnet. Die durchschnittliche Aktivierungsenergie E von Kaolpi/HA, Kaolpi/DA und Kaolpi/OA beträgt 104,44, 130,80 und 154,59 kJ mol-1. Die durchschnittliche Aktivierungsenergie E der Kaol/Alkylamin-Verbindungen korreliert positiv mit der Länge der Alkylkette. Die optimierte Mechanismusfunktion des Kaol/Alkylamin-Zersetzungsprozesses wurde als 3D-Diffusion mit der Integralfunktion G(α) = 2 bestimmt. Diese Forschungsarbeit ist von Vorteil, um den Zersetzungsmechanismus von Ton/organischen Nanokompositen besser zu verstehen und neue Materialien auf Tonbasis zu synthetisieren.
Beiträge der Autoren
HC und QfL haben das Experiment entworfen und die Arbeit überarbeitet. YZ, QhL und PX führten die Experimente durch und schrieben die Arbeit. YZ und QhL haben zu gleichen Teilen zu dieser Arbeit beigetragen.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Dr. Luyi Sun (Department of Chemical and Biomolecular Engineering and Polymer Program, Institute of Materials Science, University of Connecticut) wird für die Überarbeitung der Arbeit gedankt. Die Autoren bedanken sich für die finanzielle Unterstützung durch die National Natural Science Foundation of China (41602171), die Beijing Natural Science Foundation (8164062) und das Yue Qi Young Scholar Project, China University of Mining & Technology, Beijing.
Giese, R., and Datta, P. (1973). Hydroxyl orientation in kaolinite, dickite, and nacrite. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., and De Haseth, J. A. (2007). Fourier Transform Infrared Spectrometry. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., and Guggenheim, S. (1985). Dehydroxylation of kaolinite. Am. Mineral. 70, 1-2.
Google Scholar
Schreibe einen Kommentar