Ben Valsler
Es ist nicht alles Gold, was glänzt,
oft hat man das schon gehört.
Brian Clegg zeigt eine andere Seite,
zum Narrengold – Eisensulfid.
Brian Clegg
‚There’s gold in them thar hills!‘ Or is there? Wie der Spitzname „Narrengold“ vermuten lässt, hat das Pyritmineral Eisen-II-disulfid mehr als nur eine flüchtige Ähnlichkeit mit dem Edelmetall. Mit der einfachen Formel FeS2 kann die kubische Struktur der Verbindung zur Herstellung von bemerkenswert effektiv aussehenden platonischen Formen führen, sowohl in Form von scharfkantigen Würfeln als auch von Dodekaedern, die aussehen, als seien sie hergestellt worden, obwohl die natürliche Bildung häufiger zu einer weniger klar abgegrenzten Struktur führt.

Quelle: ©
In den Kristallen von Eisendisulfid liegen die Schwefelatome paarweise vor, wobei eine der vier Bindungen des Schwefels an ein anderes Schwefelatom gebunden ist. Diese Bindungen werden beim Erhitzen aufgebrochen, wobei Eisen-II-Sulfid – FeS – und Schwefel entstehen. Dieses Verfahren wird bei der Herstellung von Schwefeldioxid eingesetzt, sowohl zur Verwendung des Gases, z. B. als Bleichmittel für Papier, als auch als erster Schritt zur Herstellung von Schwefelsäure. In jüngerer Zeit hat die Verbindung, die ein Halbleiter ist, eine Verwendung in Lithium-Eisen-Batterien gefunden, bei denen die Kathode aus Eisendisulfid besteht: Diese Batterien sind spannungskompatibel mit herkömmlichen 1,5-Volt-Zellen, halten aber wesentlich länger als alkalische Pendants.

Quelle: ©
Vielleicht war die früheste Anwendung von Eisendisulfid eine Alternative zum Feuerstein, um Funken zu schlagen – daher der Name Pyrit – und wurde auf diese Weise oft in frühen Pistolen verwendet. Es wurde auch lange Zeit für die Herstellung von Eisensulfat verwendet, das traditionell als grünes Vitriol bekannt ist. Eisendisulfid wird auch heute noch manchmal auf diese Weise verwendet, allerdings mit ausgeklügelteren Mechanismen als der traditionellen Methode, einen Haufen Pyrit im Regen stehen zu lassen und die Flüssigkeit aufzufangen, die davon abtropft.
Wenn das Mineral oxidiert, gibt es eine ziemliche Menge Wärme ab, was in Kohlebergwerken mit hohem Schwefelgehalt zu Explosionen führen kann. Diese Tendenz zur Oxidation bedeutet jedoch nicht, dass Eisen-II-disulfid immer eingeschlossen ist. Polierter Pyrit wird seit dem Altertum für Schmuck verwendet, und seine eher dunklen Kristalle (sie haben selten den Glanz von Gold) waren besonders zwischen dem späten 17. und dem frühen zwanzigsten Jahrhundert in Mode.

Quelle: ©
Markasit-Brosche
Verwirrenderweise wird Schmuck aus Pyrit als Markasit-Schmuck bezeichnet – verwirrend deshalb, weil es ein alternatives Eisen-II-Disulfid-Mineral namens Markasit gibt, bei dem die kubische Struktur zu einer so genannten orthorhombischen Form gestreckt ist. Diese Form ist für die Herstellung von Edelsteinen weniger geeignet, da sie spröder ist und leicht zerbröckelt. Der Name des Schmuckstücks (im Vereinigten Königreich oft ‚marca-seet‘ ausgesprochen) geht auf eine Zeit zurück, in der alle Formen des Minerals als Markasit bekannt waren.

Quelle: ©
Marcasit-Mineral
Eisen-II-Disulfid ist jedoch keineswegs die einzige Möglichkeit, Eisen und Schwefel zu kombinieren. Das weit weniger attraktiv aussehende Eisen-II-Sulfid ist eine schwarz gefleckte Substanz mit einer oktaedrischen Struktur um das Eisen. Die Verbindung entsteht recht häufig beim Abbau von organischem Material, sei es als schwarzer Schlamm in Sümpfen oder als dunkle Verfärbung eines verkochten Eigelbs.
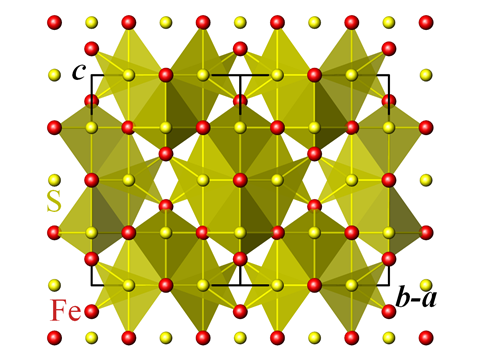
Quelle: Perditax
Kristallstruktur von Greigit
Das ist nur der Anfang für subtile Varianten von Eisensulfid. Die als Greigit, Mackinawit und Pyrrhotit bekannten Minerale weisen Varianten der Struktur auf, während das schwarze Pulver des Eisen-III-Sulfids – Fe2S3 – bisher nur künstlich hergestellt wurde. Greigit gehört zu den Fähigkeiten einer erst 1975 entdeckten Gruppe von Meeresbakterien, die die bemerkenswerte Fähigkeit besitzen, sich nach dem Magnetfeld der Erde auszurichten. Diese als „magnetotaktische“ Bakterien bezeichneten Organismen haben in ihren Zellen Kristalle, die größtenteils aus Greigit bestehen, dem Eisensulfid-Äquivalent des bekanntesten natürlich vorkommenden magnetischen Materials, dem Eisenoxid Magnetit.

Quelle: Raymond T. Downward, NASA
Geätzte Oberfläche des Mundrabilla-Meteoriten, die eine metallische Eisen-Nickel-Legierungsphase aus Kamcit (38% Ni) und Taenit (6% Ni) unten rechts, unten links und oben links zeigt. Das dunklere Material ist ein Eisensulfid (FeS oder Troilit) mit parallelen Ausscheidungen von Duabreelit (Eisenchromsulfid (FeCr2S4)).
Die interessanteste der alternativen Strukturen ist vielleicht Troilit, eine weitere Form von Eisensulfid mit hexagonaler Struktur. Obwohl es gelegentlich auf der Erde vorkommt, taucht es am häufigsten in Meteoriten auf – insbesondere in den relativ seltenen Sorten, die auf dem Mond und dem Mars entstanden sind, bevor sie bei einem Einschlag aus dem All von der Oberfläche gesprengt wurden.

Der Name Troilit wurde zu Ehren des italienischen Priesters Domenico Troili vergeben, der 1766 die erste aufgezeichnete Beobachtung eines Meteors machte, der zu einem Objekt führte, das auf dem Boden aufschlug. Troili dachte, das Hauptmaterial des Meteoriten sei Markasit (was wahrscheinlich Pyrit bedeutet), aber fast 100 Jahre später identifizierte der deutsche Mineraloge Gustav Rose die Zusammensetzung des Meteoriten als ein anderes Eisensulfid und benannte ihn nach Troili.
Eisensulfid kann ein Problem sein. Es kann sich zum Beispiel in Öl- und Gasbohrungen ablagern und die Rohre verstopfen. Anderswo hat es sich jedoch bewährt. Es mag eine einfache Verbindung zweier einfacher chemischer Elemente sein, und als Pyrit ein trügerisches falsches Gold, aber in seinen verschiedenen Formen zeigt es eine Vielfalt und Anpassungsfähigkeit, die seine Benutzer alles andere als dumm macht.
Ben Valsler
Das war Brian Clegg zur Verteidigung von Eisensulfid. Nächste Woche: Mike Freemantle mit Kerosin und einer unkonventionellen Form der Kriegsführung.
Michael Freemantle
Ungefähr einen Monat nach dem japanischen Angriff auf Pearl Harbor im Dezember 1941 kam ein amerikanischer Zahnarzt auf die Idee, japanische Städte zu zerstören, indem er winzige Brandbomben an Fledermäuse schnallte.
Ben Valsler
Finden Sie nächstes Mal heraus, was beim Projekt Röntgen passiert ist. Bis dahin können Sie eine E-Mail an [email protected] schicken oder einen Tweet an @chemistryworld senden, wenn Sie Vorschläge für Verbindungen haben, die wir in den Podcast aufnehmen sollen. Ich bin Ben Valsler, danke fürs Mitmachen.
Schreibe einen Kommentar