ORIGINAL PAPERS
Hepatitis B surface antigen detection using pooled sera. A cost-benefit analysis
E. Fernández, L. Rodrigo1, S. García, S. Riestra1 und C. Blanco
Dienst für Biochemie. Hospital de Cabueñes. Gijón. 1Dienst für Gastroenterologie. Hospital Central de Asturias. Oviedo. Spanien
Korrespondenz
ABSTRACT
Ziele: Untersuchung der Durchführbarkeit und Durchführung einer Kosten-Nutzen-Analyse einer 5-Proben-Pooling-Strategie unter Verwendung eines Enzymimmunoassays (EIA) für das Screening von Hepatitis-B-Oberflächenantigen (HBsAg).
Material und Methoden: Um die Sensitivität und Spezifität der Pooling-Methode zu bewerten, wurde jedes der 40 positiven Seren (von schwach bis stark HBsAg-positiv) und 250 negativen Seren in einem Pool mit 4 HBsAg-negativen Seren getestet. Die Nachweisgrenze für HBsAg/ad und HBsAg/ay wurde anhand von Seren aus einem Panel gereinigter Subtypen bewertet. Eine Studie unter realen Bedingungen wurde mit Pools von 340 schwangeren Frauen durchgeführt.
Ergebnisse: Die Sensitivität und Spezifität dieser Technik betrug 100 %. Der Korrelationskoeffizient zwischen den Verhältnissen von 40 Proben, die unter Einzel- und Poolbedingungen untersucht wurden, betrug 0,792 (p < 0,005). Die Pooling-Methode hat niedrigere Nachweisgrenzen für HBsAg/ad und HBsAg/ay mit 0,20 ng/mL und 0,12 ng/mL und die Einzelmethode mit 0,34 ng/mL bzw. 0,29 ng/mL. Die Pooling-Methode verliert keine Sensitivität für Werte bis zu 100 IU/L Anti-HBs in den vier Seren, die mit einem positiven Serum gemischt wurden. Die Kosten-Nutzen-Analyse ergab, dass die Pooling-Methode zwischen 30 % und 75 % der Kosten für die HBsAg-Bestimmung einsparen kann, je nachdem, ob die Seroprävalenzen 10 % oder 1 % betragen.
Schlussfolgerungen: Der gepoolte HBsAg-EIA ergab keine schlechteren Ergebnisse als der einzelne EIA-Test und war eine kosteneffektive und gültige Strategie in Gebieten mit hoher, mittlerer oder niedriger Prävalenz.
Schlüsselwörter: Hepatitis-B-Oberflächenantigen. Pooling von Seren. Cost-benefit analysis.
Rodrigo L, Fernández E, García S, Riestra S, Blanco C. Hepatitis B surface antigen detection using pooled sera. Eine Kosten-Nutzen-Analyse. Rev Esp Enferm Dig 2006; 98: 112-121.
Einführung
Die Infektion mit dem Hepatitis-B-Virus (HBV) ist eine Krankheit, die weltweit Millionen von Menschen betrifft. Ihr Hauptreservoir sind die chronischen HBV-Träger. Man schätzt, dass weltweit etwa 300 Millionen Menschen mit diesem Virus infiziert sind (1). Die medizinischen Folgen einer HBV-Infektion sind sowohl variabel als auch unvorhersehbar und hängen von Faktoren wie dem Alter und dem Immunstatus des Patienten ab. HBV ist eine anerkannte Ursache für chronische Hepatitis, Leberzirrhose und hepatozelluläres Karzinom.
Es bestehen jedoch große Unterschiede in der Prävalenz der Infektion, was dazu geführt hat, dass drei große Gebiete mit hoher, mittlerer und geringer Endemizität unterschieden werden (2). In den meisten Industrieländern liegt die Prävalenz chronischer HBV-Träger unter 2 %, und die Übertragung der Infektion findet vor allem bei Erwachsenen statt, die bestimmten Risikogruppen angehören (Drogenkonsumenten, homosexuelle Männer, promiskuitive Heterosexuelle, Beschäftigte im Gesundheitswesen) (3). In Spanien wurde eine Prävalenz von 1,2 % HBV-Trägern festgestellt (4), und die Identifizierung von HBsAg bei Blutspendern, schwangeren Frauen und Personen, die sich Autotransfusionsprogrammen unterziehen, ist obligatorisch.
Die Technik des Serumpoolings versucht, die Kosten zu senken, ohne an Wirksamkeit zu verlieren, und wurde hauptsächlich in Entwicklungsländern bei der Suche nach Antikörpern gegen das humane Immundefizienzvirus (HIV) (5-14) und das Hepatitis-C-Virus (HCV) (15-19) eingesetzt. Die mit dieser Methode erzielten Ergebnisse haben sich als sehr vielversprechend erwiesen, da sie die Kosten für Labortests erheblich gesenkt haben, ohne deren Empfindlichkeit signifikant zu verringern.
In der vorliegenden Studie wird versucht zu bewerten, ob die Serumpooling-Technik für den Nachweis von HBsAg geeignet ist, um die Faktoren zu klären, die ihre Empfindlichkeit verändern können, und eine Kosten-Nutzen-Analyse für diese Diagnosetechnik durchzuführen.
Material und Methoden
HBsAg-Bestimmung
Der Imx HBsAg-Assay (Abbott Laboratories, Abbott Park, IL), ein qualitativer Mikropartikel-Enzymimmunoassay (EIA) der dritten Generation, wurde zur HBsAg-Bestimmung verwendet. Das Vorhandensein oder Fehlen von HBsAg wird durch den Vergleich der Rate der fluoreszierenden Produktbildung mit einem Grenzwert bestimmt, der aus der Rate des negativen Kalibrators (N) berechnet wird (Humanplasma, das nicht auf HBsAg reagiert). Der Imx HBsAg-Assay berechnet ein Verhältnis zwischen der Probenrate (S) und der Rate des negativen Kalibrators. Der Cutoff-Wert (S/N) wurde für den Einzelserum-EIA auf 2 festgelegt.
Das Pooling-Verfahren wird durch Zugabe von 200 mcL zum Pool durchgeführt, d. h. durch Gewinnung einer Mischung von 40 mcL von jedem der 5 Seren, aus denen der Pool besteht (Verdünnung 1/5). Der Cutoff-Wert wurde als Mittelwert der negativen Proben plus 3 Standardabweichungen festgelegt, was einen Wert von 1 ergibt. Es wird also davon ausgegangen, dass eine nicht reaktive Probe in dieser 5er-Gruppe vorhanden ist, wenn der S/N-Koeffizient < Cutoff-Wert ist, während ein S/N-Pool > Cutoff-Wert auf das Vorhandensein mindestens einer reaktiven Probe hinweisen kann. In diesem Fall ist es erforderlich, einzelne Proben erneut zu testen, um die reaktive(n) Probe(n) zu identifizieren. Alle Tests werden in Doppelbestimmung durchgeführt.
In Übereinstimmung mit den obigen Ausführungen wurde die Spezifität durch HBsAg-Bestimmung in 50 Pools von 250 negativen Seren bewertet. Zur Berechnung der Sensitivität wurden 40 Seren mit der gleichen Konzentrationsverteilung wie die allgemeine Bevölkerung, aus der sie entnommen wurden, in einem Pool mit 4 negativen Seren getestet.
HBsAg-Subtypen (ad und ay)
Die Nachweisgrenze von Imx HBsAg für ad und ay wurde anhand von Seren aus einem Panel gereinigter HBsAg-Subtypen (Hepatitis HBsAg Sensitivity Panel, Abbott Laboratories) bewertet. Die HBsAg/ad- und HBsAg/ay-Konzentrationen reichten von 0,13 bis 2,32 ng/ml bzw. von 0,21 bis 2,24 ng/ml. Die Nachweisgrenze wurde im Einzeltest und in einem Pool mit 4 HBsAg-negativen Seren bestimmt.
Einfluss des Anti-HBs-Spiegels
Um festzustellen, ob das Vorhandensein von Anti-HBs-Antikörpern in den Seren, die mit dem gepoolten Test untersucht wurden, HBsAg neutralisieren und die Empfindlichkeit der Technik beeinträchtigen könnte, haben wir die Methode des Poolens eines Serums mit einer bekannten Konzentration von HBsAg/ad und HBsAg/ay mit vier Seren mit bekannten Anti-HBs-Titern angewandt.
Die quantitative Bestimmung von Anti-HBs wurde mit einer Mikropartikel-Enzymimmunoassay (mEIA)-Methode unter Verwendung eines AxSYm-Autoanalysators (AxSYmTM AUSAB, Abbott Laboratories, Abbott Park, IL) durchgeführt. Seren mit hohen Anti-HBs-Titern wurden von nachgeimpften HBV-Kontrollen und von Patienten gewonnen, die sich von Hepatitis B erholt haben.
Pool-Test beim Screening von HBsAg
Um die Validität des Pool-Tests zu beurteilen, wurde eine Simulation von Feldeinsätzen mit der oben genannten Methode an 1.525 Serumproben durchgeführt, die wir in einer früheren Studie zur Abschätzung der Prävalenz von HCV-Infektionen von schwangeren Frauen gewonnen hatten und deren Proben seit der Entnahme bei -20 ºC gelagert wurden. Daraus haben wir nach dem Zufallsprinzip 300 negative HBsAg- und 14 positive HBsAg-Proben ausgewählt. Die Bestimmungen erfolgten ohne vorherige Kenntnis der Zusammensetzung der Pools.
Reduzierung der Anzahl der Tests
Wenn ein Pool ein positives Ergebnis liefert, muss jede Komponente einzeln erneut getestet werden, um die HBsAg-positive Probe oder Proben zu identifizieren. Je größer also die Zahl der positiven Pools (d. h. die Prävalenz von HBsAg) ist, desto geringer ist die Verringerung der Zahl der durchgeführten Tests.
Auf dieser Grundlage wurde die prozentuale Verringerung der Zahl der Tests bei Verwendung von gepoolten Seren für das HBsAg-Screening unter den ungünstigsten und unwahrscheinlichsten Bedingungen (niedrige Prävalenz) berechnet, d. h. wenn in keinem der Pools mehr als ein positives Serum vorhanden war. Wenn zum Beispiel bei einer HBsAg-Seroprävalenz von 2 % 100 Seren in 20 Pools analysiert werden, sind 2 davon positiv. Zu den 20 ursprünglichen Bestimmungen (20 Pools) müssen also 10 Bestimmungen (10 einzeln nachgetestete Seren) hinzugefügt werden, so dass sich insgesamt 30 Bestimmungen ergeben. In diesem Beispiel könnten 70 % der Kosten eingespart werden. Um eine Kosten-Nutzen-Analyse durchzuführen, wurde der Preis für den HBsAg-Test auf 3 US-Dollar pro Probe geschätzt. Dieser Wert basiert auf dem durchschnittlichen tatsächlichen Preis des kommerziellen Kits in unserem Krankenhaus.
Statistische Analyse
Die Daten wurden in einer Datenbank gesammelt und später mit dem Statistikpaket SPSS für Windows, Release 10.0, analysiert. Es wurde die nichtparametrische lineare Korrelation von Spearman verwendet. Die Ergebnisse sind als Mittelwert ± SD angegeben. Ein Wert von p < 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Keiner der 50 Pools HBsAg-negativer Seren war positiv (S/N-Pool > 1), und die folgenden Werte des S/N-Pools wurden ermittelt: 0,767 ± 0,076 (Bereich 0,67-0,88). Bei dieser Probe lag die Spezifität dieser Pooling-Technik also bei 100 %. Andererseits ergaben alle 40 HBsAg-positiven Seren, wenn sie in gepoolter Form bestimmt wurden, S/N-Werte von mehr als 1 (wobei die Sensitivität ebenfalls 100 % betrug). Der Korrelationskoeffizient zwischen den S/N-Verhältnissen für diese 40 Proben, die als Einzelproben und als Pool untersucht wurden, betrug 0,792 (p < 0,05).
Sechsundzwanzig Prozent der Pools mit Proben mit hohen HBsAg-Titern hatten ein S/N-Verhältnis, das sogar größer war als das der Einzelprobe. Der Korrelationskoeffizient von Proben mit niedrigen HBsAg-Titern (S/N single < 25, n = 12) war jedoch ausgezeichnet (R = 0,9739, p < 0,05), wie zu sehen ist (Abb. 1).

Die Nachweisgrenze mit der Einzelmethode lag bei 0.34 ng/mL für den ad-Subtyp und 0,29 ng/mL für den ay-Subtyp, während mit der Pooling-Methode niedrigere Antigenmengen nachgewiesen wurden: 0,20 ng/mL bzw. 0,12 ng/mL. Die Ergebnisse der Anwendung des Einzel- und des Poolverfahrens auf Seren mit unterschiedlichen HBsAg/ad- und HBsAg/ay-Konzentrationen sind dargestellt (Abb. 2).

Wenn der Anti-HBs-Titer im Pool weniger als 100 IU/L beträgt, verliert das Verfahren nicht an Empfindlichkeit; selbst wenn Anti-HBs-Titer 10.000 IU/L erreichen, ist das Verfahren noch in der Lage, HBsAg-Konzentrationen von nur 1,5 ng/mL nachzuweisen. Der Einfluss der verschiedenen Anti-HBs-Konzentrationen auf die Nachweisgrenze für HBsAg-Subtypen bei Verwendung der Pooling-Methode ist dargestellt (Mittelwert von 2 Bestimmungen) (Abb. 3).
In der unter realen Bedingungen durchgeführten Untersuchung von Seren schwangerer Frauen führte die Pooling-Methode zu einer korrekten Klassifizierung aller analysierten Proben. Sensitivität und Spezifität lagen somit bei 100 %.
Mit steigender Seroprävalenz von HBsAg nimmt die prozentuale Reduktion der Testanzahl bei der Pooling-Methode ab. Es zeigt sich, dass selbst bei HBsAg-Prävalenzen von bis zu 10 % in der untersuchten Stichprobe eine Mindesteinsparung von mindestens 30 % erreicht wird (Abb. 4).

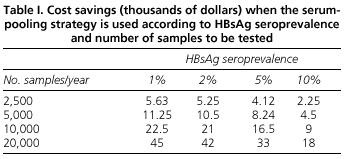
Die Analyse des wirtschaftlichen Nutzens der Serumpooling-Strategie zeigt, dass die erzielten Einsparungen sowohl von der HBsAg-Prävalenz als auch von der Anzahl der durchzuführenden Bestimmungen abhängen. In Ländern mit einer niedrigen Prävalenz wie dem unseren senkt die Pooling-Methode die Testkosten für HBsAg. Wir haben zum Beispiel geschätzt, dass bei 2.500 Bestimmungen, die in einem Labor während eines Jahres mit der Pooling-Methode durchgeführt werden, die Einsparungen 5.630 US-Dollar betragen, und im Falle eines stark ausgelasteten Krankenhauses, das jährlich 20.000 Bestimmungen durchführt, erreichen die Einsparungen 45.000 US-Dollar (Tabelle I).
Diskussion
Ein Ansatz für die Pooling-Methode ist die Beibehaltung der Verdünnung und des Endvolumens der Reaktionsmischung in jedem gepoolten Test, um die Empfindlichkeit nicht zu verlieren, wofür das Verdünnungsmittel reduziert und teilweise durch die zusätzlichen Seren ersetzt wird. Auf diese Weise ist es nicht notwendig, den Cutoff-Wert im Vergleich zur Standardmethode bei individualisierten Proben zu ändern. Die in unserer Studie verwendete Methode war jedoch automatisiert, und die Probenverdünnung wurde mit einem Autoanalyzer durchgeführt. Aus diesem Grund weist jede Probe eine Verdünnung von 1 zu 5 auf, wenn sie mit den anderen 4 Seren gemischt wird. Daher war es in unserer Studie notwendig, den Cutoff-Wert zu ändern und die Anzahl der Seren im Pool zu begrenzen, um die Sensitivität nicht zu verlieren.
Hinsichtlich der Spezifität ist anzumerken, dass der Mittelwert für die Pools nur knapp über 3 Standardabweichungen vom Cutoff-Wert lag. Somit ist in etwa 1 % der Fälle mit einem falsch positiven Ergebnis zu rechnen. Wir halten dies für akzeptabel, da die Spezifität nahezu 100 % (99,9 %) beträgt. Eine Studie mit einer größeren Anzahl negativer Proben von einer großen Anzahl verschiedener Personen ist erforderlich, um die tatsächliche Spezifität dieses Tests zu ermitteln.
Obwohl die Korrelation zwischen Einzel- und Sammelprobentests gut ist, schneidet die Regressionslinie die X-Achse bei einem S/N-Verhältnis von 3 (der entsprechende Y-Wert ist 1). Dies kann bedeuten, dass jede Probe mit einem S/N-Verhältnis zwischen 2 und 3 im Einzelproben-Test einen Wert unter 1 hätte und daher im gepoolten Test nicht erkannt würde.
Für eine Prävalenz von 1 % HBsAg-positiver Seren erreichte ein von Liu et al. (19) beschriebenes mathematisches Modell die maximale Reduzierung (80,5 %) der Anzahl der Tests bei einer Poolgröße von 11 Seren. Unserer Meinung nach könnte sich jedoch ein Problem mit der Spezifität ergeben, das auf die Auswirkung des Poolings auf die falsch-positive Rate zurückzuführen ist. Eine Zunahme unspezifischer Proteine infolge der Mischung der Seren kann zu einer Zunahme der Hintergrundfarbe führen. Bei der für unsere Studie gewählten Poolgröße von 5 und der Änderung des Cutoff-Wertes von 2 auf 1 wurden keine Einbußen bei der Sensitivität (falsch-negative Ergebnisse) oder der Spezifität (falsch-positive Ergebnisse) festgestellt.
Die Ergebnisse der vorliegenden Studie zeigen, dass die Technik des Poolings von Seren für den Nachweis von HBsAg sehr empfindlich und spezifisch ist und außerdem erhebliche wirtschaftliche Einsparungen ermöglicht. Diese Ergebnisse sind mit denen anderer Forscher vergleichbar, die die Pooling-Methode bei der Untersuchung von HCV- und HIV-Infektionen angewandt haben (5-19). Bislang wurden nur zwei Studien (20,21) über die Anwendung der Pooling-Methode bei der Untersuchung von HBV-Infektionen berichtet. In einer dieser Studien (20), die im Rahmen eines routinemäßigen pränatalen Screenings auf Hepatitis B durch die Untersuchung von 10 Probenpools durchgeführt wurde, fanden die Autoren eine niedrige Prävalenz chronischer Träger (0,43 %) und kamen zu dem Schluss, dass dies eine kosteneffiziente Methode und eine gültige Strategie in Gebieten mit geringer Seroprävalenz ist, wobei die Sensitivität auf 4,2 % geschätzt wird. Die Anwendung der Pooling-Methode auf schwangere Frauen, bei denen die Prävalenz chronischer HBsAg-Trägerinnen bei 0,93 % liegt, ergab in unserer Studie eine Sensitivität und Spezifität von 100 %.
Die Verteilung der beiden wichtigsten HBsAg-Subtypen (ad und ay) liegt in unserer Umgebung bei jeweils etwa 50 %, wobei ay häufiger bei Drogenabhängigen vorkommt, die den parenteralen Weg benutzen (22). Wir haben gezeigt, dass die Pooling-Methode die Empfindlichkeit verbessert, d. h. die Nachweisgrenze eines Immunoassays zur Bestimmung der beiden wichtigsten HBsAg-Subtypen senkt. Mit unserer Pooling-Methode lassen sich Mengen bis zu 0,20 ng/ml HBsAg/ad und 0,12 ng/ml HBsAg/ay nachweisen, die sogar unter den mit der Standardmethode erzielten Werten liegen. Der Befund einer erhöhten Empfindlichkeit bei Pooltests ist nicht überraschend, da dies bereits von anderen Autoren berichtet wurde (16). Es ist wichtig, die Empfindlichkeit des für den Pooltest verwendeten EIA-Kits zu beurteilen, da nicht alle Kits für das Screening von Pools geeignet sind, wie dies bei Antikörpern gegen das Hepatitis-C-Virus nachgewiesen wurde (23,24).
Das Vorhandensein von Anti-HBs in den Poolseren könnte die Empfindlichkeit der Technik verändern, jedoch nur in signifikanter Weise bei Titern von mehr als 10.000 IU/mL, die nur bei Proben aus Kontrollstudien nach der Impfung festgestellt wurden; in dieser Situation ist die Bestimmung von HBsAg nicht angezeigt. Tatsächlich stellten Cunninghan et al. (20) fest, dass nur 4,5 % der Pools mit Seren schwangerer Frauen einen Anti-HBs-Titer von mehr als 7.500 IU/L aufwiesen. Unter Berücksichtigung dieser Einschränkung der Sensitivität der Pooling-Methode stellten sie fest, dass diese ebenfalls eine Sensitivität und Spezifität von etwa 100 % aufweist. Unsere Ergebnisse könnten in anderen Gebieten mit niedriger Prävalenz reproduzierbar sein, sollten aber zuvor in Gebieten mit hoher HBV-Endemizität nachgewiesen werden. In diesen Gebieten ist die Mehrheit der Bevölkerung bereits gegen das Virus immunisiert, und es ist möglich, dass die in den Seren gefundenen Anti-HBs-Titer leicht erhöht sind.
Rabenau et al. (21) untersuchten die Sicherheit serologischer Tests in Plasmapools für HBsAg unter Verwendung eines EIA-Systems, das dem unseren ähnelt. In ihrer Studie wurde der Nachweis von HBsAg durch das Vorhandensein von niedrigen Anti-HBs-Titern nach 5 Stunden Inkubation beeinflusst. Nach der Dissoziation des Immunkomplexes war HBsAg jedoch selbst bei hohem Anti-HBs-Gehalt noch im Pool nachweisbar. In unserer Studie zeigen wir, dass nur bei Anti-HBs-Titern von mehr als 10.000 IU/L eine signifikante Abnahme der Empfindlichkeit auftritt. Diese Unterschiede können auf die Tatsache zurückzuführen sein, dass in unserem Fall die Proben ohne vorherige Inkubation getestet wurden. Dies könnte eine Antigenneutralisierung durch Immunkomplexbildung verhindern.
Wir glauben daher, dass sowohl der Anti-HBs-Titer im Serum als auch die Aufbereitung der Proben vor dem Test mit dem EIA die Empfindlichkeit der Pooling-Methode beeinflussen können. Jedes Labor, das diese Technik anwenden möchte, sollte diese beiden Faktoren berücksichtigen, bevor es sie allgemein einsetzt.
Die WHO empfiehlt die Anwendung der Serum-Pooling-Methode im Falle einer HIV-Infektion, wenn die Prävalenz der Krankheit weniger als 2 % beträgt, und mit einem maximalen Pooling von 5 Seren (25). In Anlehnung an diese Empfehlungen wenden die meisten Studien die Pooling-Methode in Gebieten mit niedriger Seroprävalenz an und empfehlen sie. In unserer Studie zeigen wir, dass das Pooling von Seren auch in Bevölkerungsgruppen mit einer hohen Prävalenz von HBsAg-Trägern kosteneffizient sein kann. Dies könnte den Einsatz in Ländern ermöglichen, die zu den Gebieten mit mittlerer und hoher Endemizität für HBV-Infektionen gehören, was im Allgemeinen mit unterentwickelten Ländern oder Entwicklungsländern übereinstimmt, d. h. mit Ländern, die einen größeren Bedarf an der Senkung der wirtschaftlichen Kosten für Labortests haben. Dennoch müssen in diesen Gebieten ähnliche Studien durchgeführt werden, um unsere Ergebnisse zu bestätigen. Es wurde jedoch bereits nachgewiesen, dass in Ländern wie Kenia, wo die Häufigkeit von HIV-Infektionen hoch ist (7,3 %), die Anwendung von Pooling für den Nachweis von HIV-Infektionen wirtschaftliche Einsparungen in Höhe von 62 % ermöglichen würde, ohne dass die Sicherheit wesentlich beeinträchtigt würde (14). In Spanien, einem Land mit geringer Endemizität für HBV-Infektionen und einer Häufigkeit von HBsAg-Trägern in der Allgemeinbevölkerung von 1,2 % (4), kann der Pooling-Test bei allen Gruppen eingesetzt werden, bei denen ein Screening auf HBsAg derzeit obligatorisch ist (z. B. bei Blutspendern, Personen, die sich Autotransfusionsprogrammen unterziehen, Screening von Schwangeren).
Die Kosten-Nutzen-Studie über die Anwendung von Techniken zum Nachweis chronischer HBV-Träger ermöglicht den Nachweis, dass die wirtschaftlichen Einsparungen größer sind, wenn sie bei einer großen Anzahl von Bestimmungen in Gruppen mit geringer Seroprävalenz erzielt werden, und dass ihr Einsatz auch in Gebieten mit hoher Infektionsprävalenz und sogar in Laboratorien, die eine kleine Anzahl von Bestimmungen durchführen, kosteneffektiv sein könnte. Wir haben wirtschaftliche Kosteneinsparungen in Abhängigkeit von der unterschiedlichen HBsAg-Prävalenz und der Anzahl der jährlich durchzuführenden Tests nachgewiesen. In unserem Gebiet konnten durch die Anwendung der Pooling-Methode im Vergleich zur Einzelmethode etwa 74 % der gesamten wirtschaftlichen Kosten eingespart werden.
Einige Forscher haben in letzter Zeit begonnen, Strategien zum Nachweis viraler Nukleinsäuren bei Blutspendern mit Hilfe der Polymerase-Kettenreaktion (PCR) zu praktizieren, um die Sicherheit bei der Transfusion von Blutderivaten zu erhöhen (26-29). Da es aus wirtschaftlichen Gründen und wegen des hohen Arbeitsaufwands nicht möglich ist, individuelle Screenings durchzuführen, wird heute die Methode des Poolings von serologisch negativen Blutproben angewandt. Dieses Verfahren könnte die Blutsicherheit durch ein systematisches Screening von Blutspenden bei relativ geringen Kosten erhöhen. Da eine der Haupteinschränkungen bei der Anwendung dieser Methoden in der Wirtschaftlichkeit liegt, glauben wir, dass mit unserer Studie eine theoretische Grundlage für den Einsatz eines zweistufigen Screenings auf HBV-, HCV- und HIV-Infektionen zu relativ geringen wirtschaftlichen Kosten geschaffen werden könnte. In der ersten Phase könnte ein kommerzieller EIA auf einen Pool von Spenderseren angewandt werden; in der zweiten Phase könnte die Anwendung von PCR-Techniken auf einen Pool von seronegativen Proben die Sicherheit der Analyse erhöhen. Bis künftige Studien den Wert dieser Technik bei Blutspendern nachweisen können, glauben wir, dass sie nur für diagnostische und epidemiologische Tests eingesetzt werden könnte.
Wir kommen zu dem Schluss, dass die Anwendung des EIA auf gepoolte Seren eine empfindliche und spezifische Methode für den Nachweis der beiden wichtigsten HBsAg-Subtypen in einem Gebiet mit geringer Seroprävalenz ist. Die Empfindlichkeit nimmt nur dann ab, wenn in den gepoolten Seren sehr hohe Anti-HB-Titer vorhanden sind. Die Pooling-Technik ist eine Methode, die auch finanzielle Einsparungen ermöglichen kann, wenn sie bei der Untersuchung von Populationen mit einer hohen Prävalenz von HBsAg-Trägern eingesetzt wird. Wir glauben, dass weitere Studien notwendig sind, um diese Ergebnisse zu bestätigen.
Danksagung
Wir möchten David H. Wallace (Mitglied der European Association of Science Editors und des Council of Biological Editors) für die englische Übersetzung des Manuskripts danken.
1. Maynard JE. Hepatitis B: globale Bedeutung und Notwendigkeit der Kontrolle. Vaccine 1990; 8 (Supl.): 18s-20s.
2. Margolis HS, Alter MJ, Hadler SC. Hepatitis B: Entwicklung der Epidemiologie und Auswirkungen auf die Kontrolle. Sem Liver Dis 1991; 11: 84-92.
3. Alter MJ, Mast EE. Die Epidemiologie der viralen Hepatitis in den Vereinigten Staaten. Gastroenterol Clin North Am 1994; 23: 437-55.
4. Suárez A, Riestra S, Navascués CA, et al. Positive HBsAg-Blutspender in Asturien (Spanien): aktuelle Prävalenz und ihre Bedeutung. (Engl. Zusammenfassung). Med Clin (Barcelona) 1994; 102: 329-32.
5. Emmanuel JC, Basset MT, Smith HJ, Jacobs JA. Pooling von Seren für Tests auf das humane Immundefizienzvirus (HIV): eine wirtschaftliche Methode für den Einsatz in Entwicklungsländern. J Clin Pathol 1988; 41: 582-5.
6. Kline RL, Brothers TA, Brookmeyer R, et al. Evaluation of human immunodeficiency virus seroprevalence in population surveys using pooled sera. J Clin Microbiol 1989; 27: 1449-52.
7. Cahoon-Young B, Chandler A, Livermore T, et al. Sensitivity and specificity of pooled versus individual sera in a human immunodeficiency virus antibody prevalence study. J Clin Microbiol 1989; 27: 1893-5.
8. Frosner GG, Dobler G, von Sonnenburg FJ. Kostenreduzierung von nicht verknüpften Tests auf Anti-HIV durch Untersuchung von gepoolten Seren. AIDS 1990; 4: 73-5.
9. Behets F, Bertozzi S, Kasali M, et al. Erfolgreiche Verwendung von gepoolten Seren zur Bestimmung der HIV-1-Seroprävalenz in Zaire mit Entwicklung von Kosteneffizienzmodellen. AIDS 1990; 4: 737-41.
10. Monzon OT, Paladin FJ, Dimaandal E, et al. Relevanz von Antikörpergehalt und Testformat bei der HIV-Testung von gepoolten Seren. AIDS 1992; 6: 43-8.
11. Tamashiro H, Maskill W, Emmanuel J, et al. Reducing the cost of HIV antibody testing. Lancet 1993; 342: 87-90.
12. Perriens JH, Magazani K, Kapila N, et al. Verwendung eines Schnelltests und eines ELISA für das HIV-Antikörper-Screening von Serum-Poolproben in Lubumbashi, Zaire. J Virol Methods 1993; 41: 213-21.
13. McMahon EJ, Fang C, Layug L, Sandler SG. Pooling of blood donor samples to reduce the cost of HIV-1 antibody testing. Vox Sang 1995; 68: 215-9.
14. Verstraeten T, Farah B, Duchateau L, Matu R. Pooling sera to reduce the cost of HIV surveillance: a feasibility study in a rural Kenyan district. Trop Med Int Health 1998; 3: 747-50.
15. Kamel MA, Ghaffar YA, Wasef MA, et al. Hohe HCV-Prävalenz bei ägyptischen Blutspendern. Lancet 1992; 340: 427.
16. Neil AGS, Conradie JD. Low cost anti-HCV screening of blood donors. Lancet 1992; 340: 1096.
17. Fernández E, Riestra S, García S, Rodríguez S. Pooltests zum Nachweis einer Hepatitis-C-Virusinfektion. J Hepatol 1995; 23: 236.
18. García Z, Taylor L, Ruano A, et al. Evaluation einer Pooling-Methode für das routinemäßige Anti-HCV-Screening von Blutspendern zur Senkung der Kostenbelastung der Blutbanken in Entwicklungsländern. J Med Virol 1996; 49: 218-22.
19. Liu P, Shi ZX, Zhang YC, et al. A prospective study of a serum-pooling strategy in screening blood donors for antibody to hepatitis C virus. Transfusion 1997; 37: 732-6.
20. Cunningham R, Northwood JL, Kelly CD, et al. Routinemäßiges pränatales Screening auf Hepatitis B unter Verwendung gepoolter Seren: Validierung und Rückblick auf 10 Jahre Erfahrung. J Clin Pathol 1998; 51: 392-5.
21. Rabenau H, Schutz R, Berger A, et al. How accurate is serologic testing of plasma pools for hepatitis B virus surface antigen, anti-human immunodeficiency virus 1 and 2, and anti-hepatitis C virus? (Englische Zusammenfassung). Infus Transfus 1996; 23: 124-30.
22. Echevarría JE, León P, López JA, et al. HBsAg-Subtyp-Verteilung in verschiedenen Populationen von HBsAg-Trägern in Spanien. Eur J Epidemiol 1995; 11: 39-45.
23. Neill AGS, Conradie JD. Pooltests für das Hepatitis-C-Virus. Lancet 1994; 343: 738.
24. Liu P, Shi ZX, Zhang YC, Zhang XY. Vergleichende Studie über 4 EIA-Kits zum Screening von Antikörpern gegen das Hepatitis-C-Virus in gepoolten Seren. Biomed Environ Sci 1998; 11: 75-80.
25. Empfehlungen für den Test auf HIV-Antikörper in Serumpools. WHO Weekly Epidemiol Rec 1991; 44: 316-27.
26. Lefrere JJ, Coste J, Defer C, et al. Screening von Blutspenden auf virale Genome: multizentrische Studie zur Echtzeit-Simulation unter Verwendung von gepoolten Proben am Modell des Hepatitis-C-Virus-RNA-Nachweises. Transfusion 1998; 38: 915-23.
27. Yerly S, Pedrocchi M, Perrin L. The use of polymerase chain reaction in plasma pools for the concomitant detection of hepatitis C virus and HIV type 1 RNA. Transfusion 1998; 38: 908-14.
28. Schottstedt V, Tuma W, Bunger G, Lefevre H. PCR for HBV, HCV and HIV-1 experiences and first results from a routine screening programme in a large blood transfusion service. Biologicals 1998; 26: 101-4.
29. Morandi PA, Schockmel GA, Yerly S, et al. Detection of human immunodeficiency virus type 1 (HIV-1) RNA in pools of sera negative for antibodies to HIV-1 and HIV-2. J Clin Microbiol 1998; 36: 1534-8.
Schreibe einen Kommentar