Zu den Elementen der Gruppe 13 gehören die Metalle nach dem Übergang.
Der Begriff Metalle nach dem Übergang bezieht sich auf die Elemente, die Metalle nach den Übergangsmetallen sind. Wie beim Metalloid-Konzept gibt es keinen allgemeinen Konsens darüber, was genau ein Post-Übergangsmetall ist. Glücklicherweise ist es in der Praxis weniger wichtig, genau zu definieren, was ein Post-Übergangsmetall ist und was nicht, als zu verstehen, warum es hilfreich sein könnte, Elemente als Post-Übergangsmetall zu klassifizieren.
Die Hauptmerkmale der Post-Übergangs-Metalle sind, dass sie relativ elektronenreich und elektronegativ sind, verglichen mit dem, was man sich klassischerweise unter einem Metall vorstellt. Grob ausgedrückt bedeutet dies, dass sie einen relativ niedrigeren Schmelzpunkt haben (da mehr bindungsfeindliche Niveaus in der Bandstruktur besetzt sind), eine größere Vorliebe für kovalente Bindungen haben und spröder sind als andere Metalle (aufgrund der daraus resultierenden gerichteten Bindungen). Aufgrund ihres Elektronenreichtums neigen sie dazu, weiche Kationen zu bilden.
Es gibt mehrere Systeme zur Klassifizierung von Elementen, die zu den Nachübergangsmetallen gehören. Zu den wichtigsten gehören:
- Metalle, die dem d-Block folgen. Nach dieser Definition werden nur die Metalle der Gruppen 13 und höher sowie der Reihen 3 und höher einbezogen, die relativ weiche und elektronenreiche Kationen bilden und eine bedeutende Kovalenz in ihrer Bindung aufweisen. Wird dieses Schema jedoch zu starr angewandt, wird Al ausgeschlossen, da es technisch gesehen nicht dem d-Block folgt (und eine nicht gefüllte (n-1)d-Unterschale hat), und die Metalloide werden ausgeschlossen, obwohl viele von ihnen ebenfalls relativ weiche und elektronenreiche Kationen mit gefüllten (n-1)d-Unterschalen bilden. Ein weiterer Nachteil dieses Systems besteht darin, dass es die Frage, welche Elemente als Post-Übergangsmetalle klassifiziert werden sollten, mit der heiklen Frage verwickelt, welche Elemente als Metalle bzw. Metalloide klassifiziert werden sollten.
- Metalle und Metalloide des p-Blocks. Dieses System hat den Vorteil, dass es die interessanten und einzigartigen Eigenschaften der Metalle und Metalloide des p-Blocks sowie die Kontinuität dieser Eigenschaften durch den p-Block hervorhebt. Daher wird es in den folgenden Abschnitten verwendet. Sie hat jedoch den Nachteil, dass sie Metalle wie Zn, Cd und Hg ausschließt, die viele Verbindungen bilden, in denen das Metall eine (n-1)d10-Konfiguration hat.
- Metalle, die den Übergangselementen in dem Sinne folgen, dass sie Ionen mit einer vollständig gefüllten (n-1)d-Valenzschale bilden, kommen manchmal zusammen mit Al und den Metalloiden des p-Blocks vor. Diese Definition fügt Zn, Cd und Hg (und manchmal Cu, Ag und Au) hinzu, da sie Ionen mit einer (n-1)d 10 Valenzelektronenkonfiguration wie Zn2+, Cd2+ und Hg2+ (und Cu+, Ag+ und Au+) bilden. Da in diesem Kapitel nur die Elemente des p-Blocks für die Zwecke dieses Kapitels betrachtet werden, ist dieses System funktionell identisch mit dem System 2.
Unabhängig davon, welches Klassifizierungsschema man verwendet, ist es oft hilfreicher, die Klassifizierung von Elementen als Post-Transiton-Metalle als eine Möglichkeit zu betrachten, Ähnlichkeiten in den chemischen Eigenschaften einer Gruppe von Elementen hervorzuheben, als als eine Möglichkeit, zu betonen, wie sich Post-Transition-Metalle von anderen Metallen unterscheiden. Die Metalle nach dem Übergang sind nicht die einzigen, die weiche Kationen oder Verbindungen bilden, die besser durch kovalente Bindungen zusammengehalten werden. Wie in den vorangegangenen Abschnitten deutlich wurde, bilden selbst Alkalimetalle unter den richtigen Umständen Anionen, und viele Metallverbindungen lassen sich besser durch Kovalenz als durch ionische Wechselwirkungen beschreiben. Dies wurde bereits in der Chemie der Erdalkalimetalle Be und Mg deutlich, die im vorherigen Abschnitt behandelt wurden. In den folgenden Kapiteln werden die Bindungen und die Reaktivität in Koordinationskomplexen und metallorganischen Verbindungen weitgehend mit kovalenten Begriffen beschrieben.
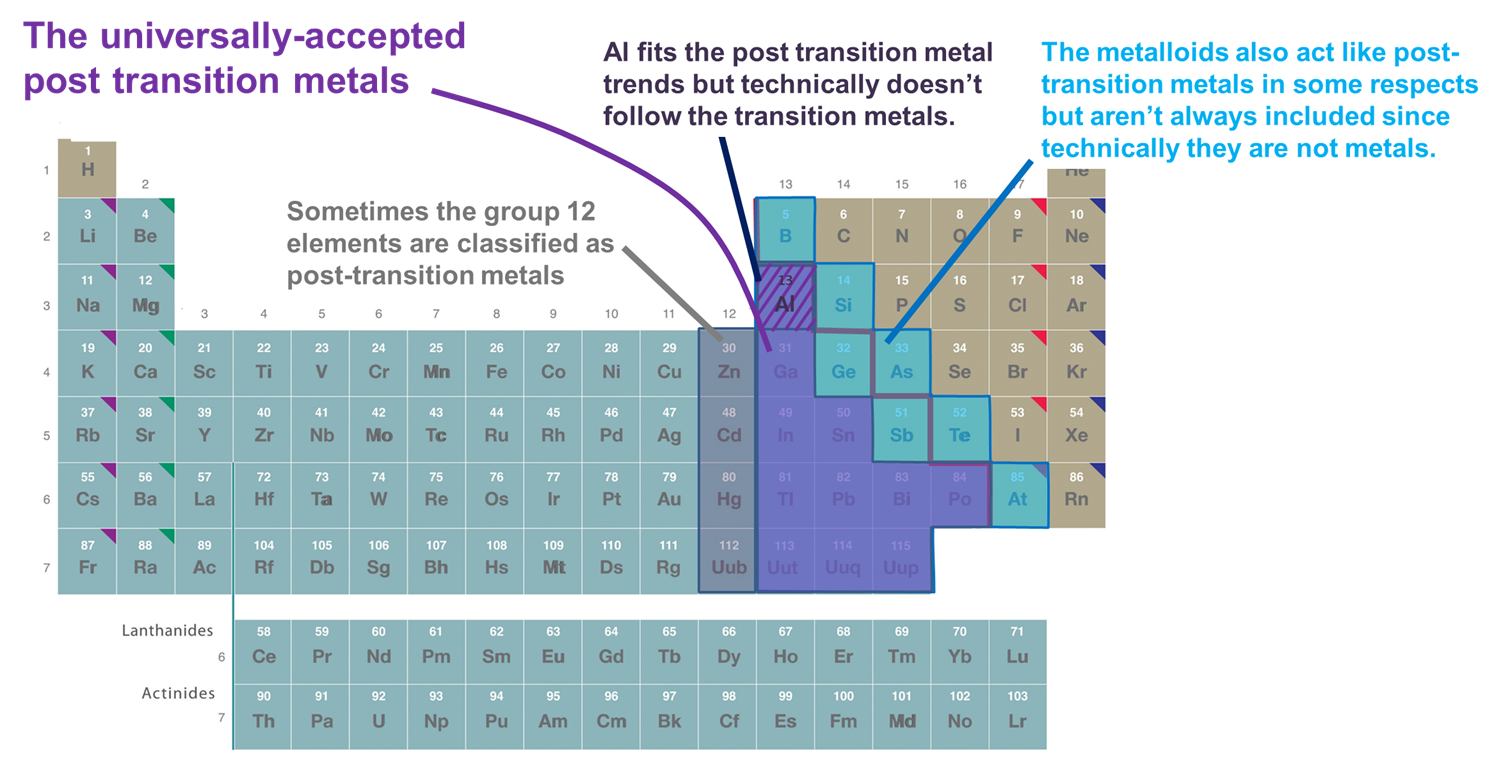
Abbildung \(\sf{\PageIndex{2}}\). Einige der Elemente, die als Post-Übergangsmetalle klassifiziert sind. Die violett dargestellten Elemente werden allgemein akzeptiert, da sie Metalle sind und eindeutig auf die Übergangsmetalle folgen, während die Metalle der Gruppen 12 (und manchmal 11), Al und die Metalloide manchmal mit einbezogen werden, da sie sich in wichtigen Aspekten wie die anderen Nach-Übergangsmetalle verhalten. Das Periodensystem ist an das https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atome%2C_Moleküle%2C_und_Ionen/2.5%3A_Das_Periodensystem.
angepasst.
Schreibe einen Kommentar