Molekulare Dipolmomente
In Molekülen, die mehr als eine polare Bindung enthalten, ist das molekulare Dipolmoment nur die Vektorkombination dessen, was als einzelne „Bindungsdipolmomente“ betrachtet werden kann. Mathematisch gesehen sind Dipolmomente Vektoren; sie besitzen sowohl einen Betrag als auch eine Richtung. Das Dipolmoment eines Moleküls ist also die Vektorsumme der Dipolmomente der einzelnen Bindungen des Moleküls. Wenn sich die Dipolmomente der einzelnen Bindungen gegenseitig aufheben, gibt es kein Nettodipolmoment. Dies ist der Fall bei CO2, einem linearen Molekül (Abbildung \(\PageIndex{1a}\)). Jede C-O-Bindung in CO2 ist polar, dennoch zeigen Experimente, dass das CO2-Molekül kein Dipolmoment hat. Da die beiden Dipole der C-O-Bindung in CO2 gleich groß und um 180° zueinander ausgerichtet sind, heben sie sich auf. Infolgedessen hat das CO2-Molekül kein Nettodipolmoment, obwohl es eine beträchtliche Ladungstrennung aufweist. Im Gegensatz dazu ist das H2O-Molekül nicht linear (Abbildung \(\PageIndex{1b}\)); es ist im dreidimensionalen Raum gekrümmt, so dass sich die Dipolmomente nicht gegenseitig aufheben. Daher hat ein Molekül wie H2O ein Nettodipolmoment. Wir gehen davon aus, dass sich die negative Ladung auf dem Sauerstoff, dem elektronegativeren Atom, und die positive Ladung auf den beiden Wasserstoffen konzentriert. Diese Ladungspolarisierung ermöglicht es H2O, Wasserstoffbrückenbindungen mit anderen polarisierten oder geladenen Spezies einzugehen, einschließlich anderer Wassermoleküle.
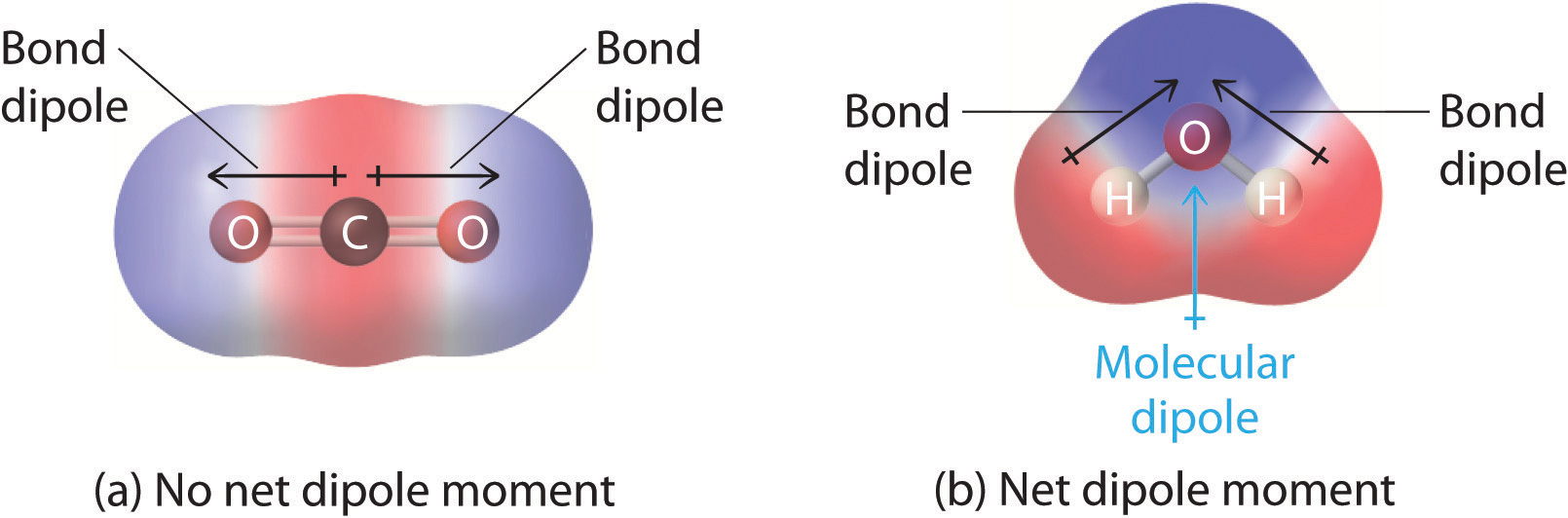
Abbildung \(\PageIndex{1}\): Wie einzelne Bindungsdipolmomente addiert werden, um ein Gesamtmoleküldipolmoment für zwei triatomische Moleküle mit unterschiedlichen Strukturen zu ergeben. (a) In CO2 sind die C-O-Bindungsdipole gleich groß, aber in entgegengesetzte Richtungen ausgerichtet (um 180°). Ihre Vektorsumme ist Null, so dass CO2 keinen Nettodipol hat. (b) In H2O sind die Dipole der O-H-Bindung ebenfalls gleich groß, aber sie sind unter 104,5° zueinander ausgerichtet. Daher ist die Vektorsumme nicht Null, und H2O hat ein Nettodipolmoment.
Das Folgende ist eine vereinfachte Gleichung für ein einfaches getrenntes Zweiladungssystem, das in zweiatomigen Molekülen oder bei der Betrachtung eines Bindungsdipols innerhalb eines Moleküls vorhanden ist.
\
Dieser Bindungsdipol, µ (griechisch mu), wird als der Dipol aus einer Ladungstrennung über eine Distanz \(r\) zwischen den Teilladungen \(Q^+\) und \(Q^-\) (oder den gebräuchlicheren Begriffen \(δ^+\) – \(δ^-\)) interpretiert; die Orientierung des Dipols ist entlang der Achse der Bindung. Die Einheiten für Dipolmomente sind in der Regel Debyes (D), wobei ein Debye 3,336 x 1030 Coulombmeter (C – m) in SI-Einheiten entspricht. Betrachten wir ein einfaches System aus einem einzelnen Elektron und einem Proton, die durch einen festen Abstand getrennt sind. Die Einheitsladung eines Elektrons ist 1,60 X 1019 C und das Proton & Elektron ist 100 pm voneinander entfernt (etwa die Länge einer typischen kovalenten Bindung), das Dipolmoment wird wie folgt berechnet:
\ &= (1,60 \mal 10^{-19}\, C)(1,00 \mal 10^{-10} \,m) \nonumber \\\ &= 1,60 \mal 10^{-29} \,C \cdot m \label{2} \end{align}\]
\ &= 4,80\; D \label{3} \end{align}\]
\(4,80\; D\) ist ein wichtiger Referenzwert und steht für eine reine Ladung von +1 und -1, die durch 100 pm getrennt sind. Wenn jedoch die Ladungstrennung vergrößert wird, steigt das Dipolmoment (linear):
- Wenn das Proton und das Elektron durch 120 pm getrennt wären:
\
- Wenn Proton und Elektron durch 150 pm getrennt wären:
\
- Wenn Proton und Elektron durch 200 pm getrennt wären:
\
Beispiel \(\PageIndex{1}\): Wasser
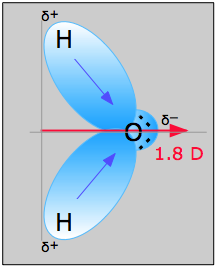
Aus dem Wassermolekül in Abbildung \(\PageIndex{1}\) lassen sich Richtung und Größe des Dipolmoments bestimmen. Aus den Elektronegativitäten von Sauerstoff und Wasserstoff ergibt sich eine Differenz von 1,2e für jede der Wasserstoff-Sauerstoff-Bindungen. Da der Sauerstoff das elektronegativere Atom ist, übt er eine stärkere Anziehungskraft auf die gemeinsam genutzten Elektronen aus; außerdem besitzt er zwei einsame Elektronenpaare. Daraus lässt sich schließen, dass das Dipolmoment von den beiden Wasserstoffatomen in Richtung des Sauerstoffatoms zeigt. Anhand der obigen Gleichung wird das Dipolmoment auf 1,85 D berechnet, indem man den Abstand zwischen den Sauerstoff- und Wasserstoffatomen mit der Ladungsdifferenz zwischen ihnen multipliziert und dann die Komponenten ermittelt, die jeweils in die Richtung des Nettodipolmoments zeigen (der Winkel des Moleküls beträgt 104.5˚).
Das Bindungsmoment der O-H-Bindung =1,5 D, also ist das Nettodipolmoment
\
Schreibe einen Kommentar