Reine Stoffe und Gemische
Ein reiner chemischer Stoff ist jeder Stoff, der eine feste chemische Zusammensetzung und charakteristische Eigenschaften hat. Sauerstoff zum Beispiel ist ein reiner chemischer Stoff, der bei 25 °C ein farbloses, geruchloses Gas ist. Die wenigsten Stoffproben bestehen aus reinen Stoffen, die meisten sind Gemische, d. h. Kombinationen aus zwei oder mehr reinen Stoffen in variablen Anteilen, bei denen die einzelnen Stoffe ihre Identität behalten. Luft, Leitungswasser, Milch, Schimmelkäse, Brot und Schmutz sind allesamt Gemische. Wenn sich alle Teile eines Stoffes im gleichen Zustand befinden, keine sichtbaren Grenzen haben und überall gleich sind, dann ist der Stoff homogen. Beispiele für homogene Gemische sind die Luft, die wir atmen, und das Leitungswasser, das wir trinken. Homogene Gemische werden auch als Lösungen bezeichnet. So ist Luft eine Lösung aus Stickstoff, Sauerstoff, Wasserdampf, Kohlendioxid und verschiedenen anderen Gasen; Leitungswasser ist eine Lösung aus kleinen Mengen verschiedener Stoffe in Wasser. Die spezifischen Zusammensetzungen dieser beiden Lösungen sind jedoch nicht festgelegt, sondern hängen sowohl von der Quelle als auch vom Standort ab; so ist beispielsweise die Zusammensetzung des Leitungswassers in Boise, Idaho, nicht dieselbe wie die des Leitungswassers in Buffalo, New York. Obwohl die meisten Lösungen, denen wir begegnen, flüssig sind, können Lösungen auch fest sein. Die graue Substanz, die von einigen Zahnärzten immer noch zum Füllen von Zahnlöchern verwendet wird, ist eine komplexe feste Lösung, die zu 50 % aus Quecksilber und zu 50 % aus einem Pulver besteht, das hauptsächlich Silber, Zinn und Kupfer sowie geringe Mengen an Zink und Quecksilber enthält. Feste Lösungen aus zwei oder mehr Metallen werden allgemein als Legierungen bezeichnet.
Wenn die Zusammensetzung eines Materials nicht völlig einheitlich ist, dann ist es heterogen (z. B. Schokoladenteig, Blauschimmelkäse und Schmutz). Mischungen, die homogen zu sein scheinen, erweisen sich bei der mikroskopischen Untersuchung oft als heterogen. Milch zum Beispiel scheint homogen zu sein, aber wenn man sie unter dem Mikroskop untersucht, besteht sie eindeutig aus winzigen Fett- und Proteinkügelchen, die in Wasser verteilt sind. Die Bestandteile heterogener Gemische können in der Regel mit einfachen Mitteln getrennt werden. Fest-Flüssig-Gemische wie Sand in Wasser oder Teeblätter in Tee lassen sich leicht durch Filtration trennen. Dabei wird das Gemisch durch eine Barriere, z. B. ein Sieb, mit Löchern oder Poren geleitet, die kleiner sind als die Feststoffteilchen. Im Prinzip können Mischungen aus zwei oder mehr Feststoffen, wie z. B. Zucker und Salz, durch mikroskopische Untersuchung und Sortierung getrennt werden. In der Regel sind jedoch komplexere Verfahren erforderlich, wie z. B. beim Trennen von Goldnuggets aus Flusskies durch Schwenken. Zunächst werden die Feststoffe aus dem Flusswasser herausgefiltert, dann werden die Feststoffe durch Inspektion getrennt. Ist das Gold in Gestein eingebettet, muss es möglicherweise mit chemischen Methoden isoliert werden.
-and-Milk-(left).jpg?revision=1)
Abbildung 1.2.2: Ein heterogenes Gemisch. Unter dem Mikroskop ist Vollmilch tatsächlich ein heterogenes Gemisch aus in Wasser verteilten Fett- und Eiweißkügelchen. Abbildung mit Genehmigung von Wikipedia
Homogene Gemische (Lösungen) können durch physikalische Verfahren, die auf Unterschieden in einer physikalischen Eigenschaft beruhen, wie z. B. Unterschieden in ihren Siedepunkten, in ihre Bestandteile getrennt werden. Zwei dieser Trennverfahren sind Destillation und Kristallisation. Bei der Destillation macht man sich die unterschiedliche Flüchtigkeit zunutze, ein Maß dafür, wie leicht sich ein Stoff bei einer bestimmten Temperatur in ein Gas umwandelt. Eine einfache Destillationsapparatur zur Trennung eines Gemischs von Stoffen, von denen mindestens einer eine Flüssigkeit ist. Die flüchtigste Komponente siedet zuerst und kondensiert im wassergekühlten Kondensator zu einer Flüssigkeit zurück, aus der sie in den Auffangkolben fließt. Wird zum Beispiel eine Lösung aus Salz und Wasser destilliert, so sammelt sich die flüchtigere Komponente, das reine Wasser, im Auffangkolben, während das Salz im Destillationskolben verbleibt.

Abbildung 1.2.3: Die Destillation einer Lösung von Kochsalz in Wasser. Die Lösung von Salz in Wasser wird im Destillierkolben bis zum Sieden erhitzt. Der entstehende Dampf ist mit der flüchtigeren Komponente (Wasser) angereichert, die im kalten Kondensator zu einer Flüssigkeit kondensiert und dann im Auffangkolben gesammelt wird.
Gemische von zwei oder mehr Flüssigkeiten mit unterschiedlichen Siedepunkten können mit einer komplexeren Destillationsapparatur getrennt werden. Ein Beispiel ist die Raffination von Rohöl zu einer Reihe von nützlichen Produkten: Flugkraftstoff, Benzin, Kerosin, Dieselkraftstoff und Schmieröl (in der ungefähren Reihenfolge der abnehmenden Flüchtigkeit). Ein weiteres Beispiel ist die Destillation von alkoholischen Getränken wie Branntwein oder Whiskey. Dieses relativ einfache Verfahren bereitete den Bundesbehörden in den 1920er Jahren während der Prohibition mehr als nur ein wenig Kopfzerbrechen, als sich illegale Destillierapparate in entlegenen Regionen der Vereinigten Staaten ausbreiteten.
Die Kristallisation trennt Gemische auf der Grundlage von Unterschieden in der Löslichkeit, einem Maß dafür, wie viel feste Substanz in einer bestimmten Menge einer bestimmten Flüssigkeit aufgelöst bleibt. Die meisten Stoffe sind bei höheren Temperaturen besser löslich, so dass ein Gemisch aus zwei oder mehr Stoffen bei erhöhter Temperatur aufgelöst und dann langsam abgekühlt werden kann. Alternativ kann man die Flüssigkeit, das so genannte Lösungsmittel, auch verdampfen lassen. In beiden Fällen bildet die am wenigsten lösliche der gelösten Substanzen, also diejenige, die am wenigsten wahrscheinlich in der Lösung verbleibt, in der Regel zuerst Kristalle, und diese Kristalle können durch Filtration aus der verbleibenden Lösung entfernt werden.

Abbildung 1.2.4: Die Kristallisation von Natriumacetat aus einer konzentrierten Lösung von Natriumacetat in Wasser. Die Zugabe eines kleinen „Impfkristalls“ (a) bewirkt, dass die Verbindung weiße Kristalle bildet, die wachsen und schließlich den größten Teil des Kolbens ausfüllen. Das Video ist hier zu finden: https://www.youtube.com/watch?v=BLq5NibwV5g
Die meisten Gemische können in reine Substanzen getrennt werden, die entweder Elemente oder Verbindungen sein können. Ein Element, wie z. B. graues, metallisches Natrium, ist ein Stoff, der nicht durch chemische Veränderungen in einfachere Stoffe zerlegt werden kann; eine Verbindung, wie z. B. weißes, kristallines Natriumchlorid, enthält zwei oder mehr Elemente und hat chemische und physikalische Eigenschaften, die sich in der Regel von denen der Elemente unterscheiden, aus denen es zusammengesetzt ist. Bis auf wenige Ausnahmen hat eine bestimmte Verbindung unabhängig von ihrer Herkunft oder Geschichte die gleiche elementare Zusammensetzung (die gleichen Elemente in den gleichen Anteilen). Die chemische Zusammensetzung eines Stoffes wird durch einen Prozess verändert, der als chemische Veränderung bezeichnet wird. Die Umwandlung von zwei oder mehr Elementen, wie Natrium und Chlor, in eine chemische Verbindung, Natriumchlorid, ist ein Beispiel für eine chemische Veränderung, die oft als chemische Reaktion bezeichnet wird. Derzeit sind etwa 115 Elemente bekannt, aber Millionen von chemischen Verbindungen wurden aus diesen 115 Elementen hergestellt. Die bekannten Elemente sind im Periodensystem aufgeführt.
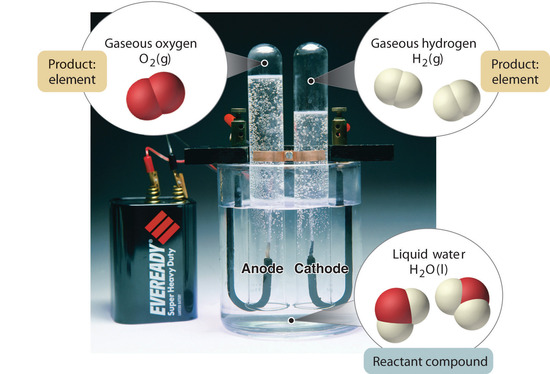
Abbildung 1.2.5: Die Zersetzung von Wasser in Wasserstoff und Sauerstoff durch Elektrolyse. Wasser ist eine chemische Verbindung; Wasserstoff und Sauerstoff sind Elemente.
Im Allgemeinen werden Verbindungen durch einen umgekehrten chemischen Prozess in ihre Elemente zerlegt. Zum Beispiel kann Wasser (eine Verbindung) durch einen Prozess, der Elektrolyse genannt wird, in Wasserstoff und Sauerstoff (beides Elemente) zerlegt werden. Bei der Elektrolyse liefert Elektrizität die nötige Energie, um eine Verbindung in ihre Bestandteile aufzuspalten (Abbildung 1.2.5). Ein ähnliches Verfahren wird in großem Umfang eingesetzt, um das Element Aluminium aus seinen Erzen zu gewinnen, die ein Gemisch von Verbindungen sind. Da für die Elektrolyse viel Energie benötigt wird, sind die Stromkosten bei weitem der größte Kostenfaktor bei der Herstellung von reinem Aluminium. Daher ist das Recycling von Aluminium sowohl kosteneffizient als auch ökologisch sinnvoll. Die allgemeine Organisation der Materie und die Methoden zur Trennung von Gemischen sind in Abbildung 1.2.6 zusammengefasst.
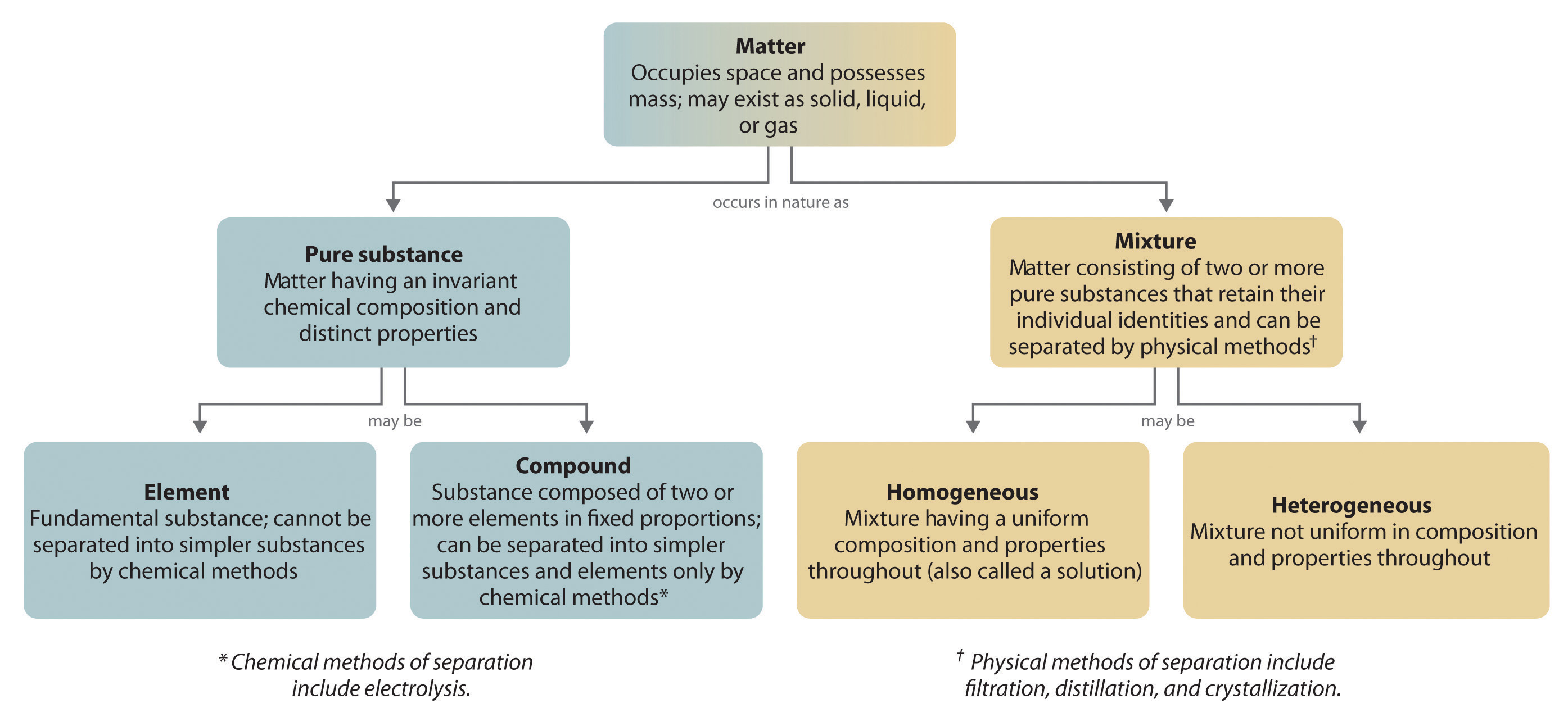
Abbildung 1.2.6: Beziehungen zwischen den Stoffarten und den Methoden zur Trennung von Gemischen
Beispiel 1.2.1
Identifiziere jeden Stoff als eine Verbindung, ein Element, ein heterogenes Gemisch oder ein homogenes Gemisch (Lösung).
- gefilterter Tee
- frisch gepresster Orangensaft
- eine Compact Disc
- Aluminiumoxid, ein weißes Pulver, das ein 2:3 Verhältnis von Aluminium- und Sauerstoffatomen
- Selen
Gegeben: eine chemische Substanz
Gefragt: ihre Klassifizierung
Strategie:
- Entscheide, ob eine Substanz chemisch rein ist. Wenn sie rein ist, ist die Substanz entweder ein Element oder eine Verbindung. Wenn ein Stoff in seine Elemente zerlegt werden kann, ist er eine Verbindung.
- Wenn ein Stoff chemisch nicht rein ist, ist er entweder ein heterogenes Gemisch oder ein homogenes Gemisch. Ist seine Zusammensetzung durchweg einheitlich, handelt es sich um ein homogenes Gemisch.
Lösung:
- Ein Tee ist eine Lösung von Verbindungen in Wasser, also chemisch nicht rein. Er wird normalerweise durch Filtration von den Teeblättern getrennt. B Da die Zusammensetzung der Lösung einheitlich ist, handelt es sich um ein homogenes Gemisch.
- A Orangensaft enthält sowohl feste Partikel (Fruchtfleisch) als auch Flüssigkeit; er ist chemisch nicht rein. B Da seine Zusammensetzung nicht durchgängig einheitlich ist, ist Orangensaft ein heterogenes Gemisch.
- A Eine Compact Disc ist ein festes Material, das mehr als ein Element enthält, wobei an seinem Rand Bereiche unterschiedlicher Zusammensetzung sichtbar sind. Eine Compact Disc ist also chemisch nicht rein. B Die Bereiche unterschiedlicher Zusammensetzung weisen darauf hin, dass eine Compact Disc ein heterogenes Gemisch ist.
- A Aluminiumoxid ist eine einzelne, chemisch reine Verbindung.
- A Selen ist eines der bekannten Elemente.
Übung 1.2.1
Bestimme jeden Stoff als eine Verbindung, ein Element, ein heterogenes Gemisch oder ein homogenes Gemisch (Lösung).
- Weißwein
- Quecksilber
- Salatdressing
- Tafelzucker (Saccharose)
Antwort:
- Lösung
- Element
- Heterogenes Gemisch
- Verbindung
Zusammenfassung
Materie kann nach physikalischen und chemischen Eigenschaften klassifiziert werden. Materie ist alles, was Raum einnimmt und Masse hat. Die drei Zustände der Materie sind fest, flüssig und gasförmig. Eine physikalische Veränderung ist die Umwandlung eines Stoffes von einem Aggregatzustand in einen anderen, ohne dass sich seine chemische Zusammensetzung ändert. Der größte Teil der Materie besteht aus Gemischen reiner Stoffe, die homogen (einheitliche Zusammensetzung) oder heterogen (verschiedene Bereiche haben unterschiedliche Zusammensetzungen und Eigenschaften) sein können. Reine Stoffe können entweder chemische Verbindungen oder Elemente sein. Verbindungen können durch chemische Reaktionen in Elemente zerlegt werden, aber Elemente können nicht mit chemischen Mitteln in einfachere Stoffe zerlegt werden. Die Eigenschaften von Stoffen können entweder als physikalische oder als chemische Eigenschaften klassifiziert werden. Wissenschaftler können physikalische Eigenschaften beobachten, ohne die Zusammensetzung des Stoffes zu verändern, während chemische Eigenschaften die Tendenz eines Stoffes beschreiben, chemische Veränderungen (chemische Reaktionen) zu erfahren, die seine chemische Zusammensetzung verändern. Physikalische Eigenschaften können intensiv oder extensiv sein. Intensive Eigenschaften sind für alle Proben gleich, hängen nicht von der Probengröße ab und umfassen beispielsweise die Farbe, den physikalischen Zustand sowie den Schmelz- und Siedepunkt. Extensive Eigenschaften hängen von der Menge des Materials ab und umfassen Masse und Volumen. Das Verhältnis von zwei extensiven Eigenschaften, Masse und Volumen, ist eine wichtige intensive Eigenschaft, die als Dichte bezeichnet wird.
Beitragende
Modifiziert von Joshua Halpern (Howard University)
Schreibe einen Kommentar