De elementen van groep 13 omvatten de metalen na de overgang.
De term metalen na de overgang verwijst naar die elementen die metalen zijn na de overgangsmetalen. Evenals bij het begrip metalloïde bestaat er geen universele consensus over wat nu precies een post-overgangsmetaal is. Gelukkig is het in de praktijk minder belangrijk om precies te definiëren wat wel en wat niet een postovergangsmetaal is, dan om te begrijpen waarom het nuttig kan zijn om elementen als postovergangsmetaal in te delen.
De belangrijkste kenmerken van de metalen na de overgang zijn dat zij relatief elektronenrijk en elektronegatief zijn in vergelijking met wat klassiek als een metaal wordt beschouwd. Ruwweg vertaalt zich dit in relatief lagere smeltpunten (omdat meer antibindingniveaus in de bandstructuur neigen te worden bezet), verhoogde voorkeur voor covalentie, en grotere brosheid dan andere metalen (wegens de resulterende directionele binding). Hun elektronenrijkdom betekent dat zij de neiging hebben zachte kationen te vormen.
Er worden verschillende systemen gebruikt om elementen in te delen als behorend tot de metalen na de overgang. De belangrijkste zijn:
- Metalen die het d-blok volgen. Volgens deze definitie worden alleen de metalen in de groepen 13 en hoger en de rijen 3 en hoger opgenomen, die betrekkelijk zachte en elektronrijke kationen vormen en een aanzienlijke covalentie in hun binding vertonen. Als dit schema echter te rigide wordt toegepast, wordt Al uitgesloten, omdat het technisch niet het d-blok volgt (en een ongevulde (n-1)d-subschil heeft) en worden de metalloïden uitgesloten, hoewel veel van hen ook betrekkelijk zachte en elektronrijke kationen vormen met gevulde (n-1)d-subschalen. Een ander nadeel van dit systeem is dat het de vraag welke elementen moeten worden ingedeeld als metalen na de overgang verstrikt met de netelige vraag welke elementen moeten worden ingedeeld als metalen vs. metalloïden.
- Metalen en metalloïden van het p-blok. Dit systeem heeft het voordeel dat het de interessante en unieke eigenschappen van de metalen en metalloïden van het p-blok benadrukt, alsmede de continuïteit in deze eigenschappen door het p-blok heen. Het zal dan ook in de volgende paragrafen worden gebruikt. Zij heeft echter het nadeel dat zij metalen als Zn, Cd en Hg uitsluit, die veel verbindingen vormen waarin het metaal een (n-1)d10 configuratie heeft.
- Metalen die de overgangselementen volgen in de zin van het vormen van ionen met een volledig volle (n-1)d valentieschil komen soms samen voor met Al en de p-blok metalloïden. Deze definitie voegt Zn, Cd, en Hg (en soms Cu, Ag, en Au) toe aangezien zij ionen vormen met een (n-1)d 10 valentie-elektronenconfiguratie zoals Zn2+, Cd2+ en Hg2+ (en Cu+, Ag+, en Au+). Aangezien in dit hoofdstuk alleen de elementen van het p-blok worden beschouwd, is dit systeem functioneel identiek aan systeem 2.
Welk classificatieschema men ook gebruikt, het is vaak nuttiger om de classificatie van elementen als post-overgangsmetalen te zien als een manier om overeenkomsten in de chemische eigenschappen van een reeks elementen te benadrukken, dan als een manier om te benadrukken hoe post-overgangsmetalen verschillen van andere metalen. De na-overgangsmetalen zijn niet de enige die zachte kationen vormen of verbindingen die beter kunnen worden omschreven als samengehouden door covalente bindingen. Zoals in de vorige hoofdstukken duidelijk werd, vormen zelfs alkalimetalen onder de juiste omstandigheden anionen en veel metaalverbindingen kunnen beter worden beschreven in termen van covalentie dan van ionische interacties. Dit was reeds duidelijk in de chemie van de aardalkalimetalen Be en Mg die in het vorige hoofdstuk werd besproken. In de volgende hoofdstukken zullen de binding en reactiviteit in coördinatiecomplexen en organometaalverbindingen grotendeels in covalente termen worden beschreven.
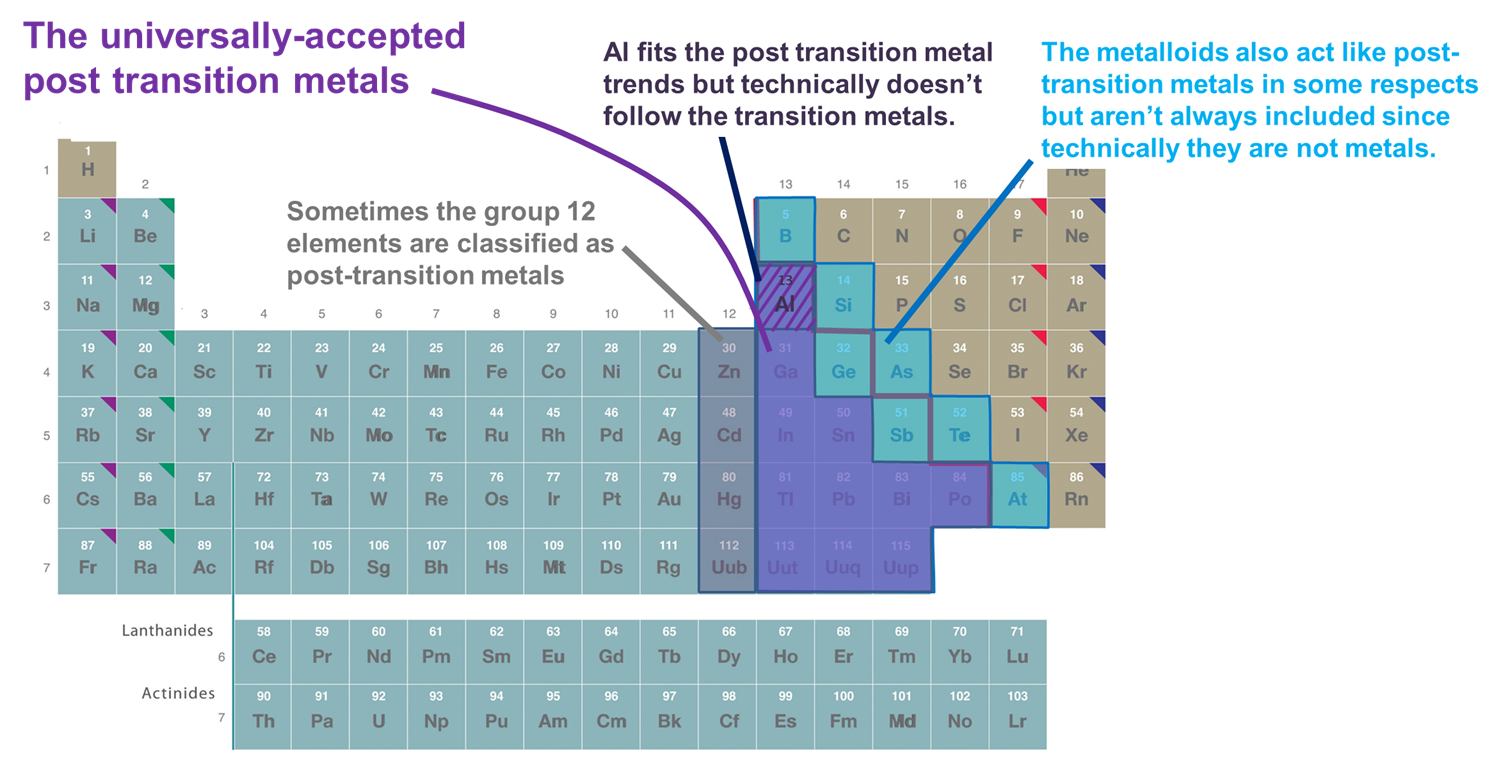
Figuurtje (\sf{PageIndex{2}}). Enkele van de elementen geclassificeerd als na-overgangsmetalen. De in paars aangegeven elementen zijn algemeen aanvaard omdat het metalen zijn en duidelijk volgen op de overgangsmetalen, terwijl de metalen van groep 12 (en soms 11), Al, en de metalloïden soms worden opgenomen omdat zij zich in belangrijke opzichten gedragen als de andere metalen na de overgang. Het periodiek systeem is aangepast aan dat van https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atoms%2C_Molecules%2C_and_Ions/2.5%3A_The_Periodic_Table.
Geef een antwoord