Moleculaire dipoolmomenten
In moleculen die meer dan één polaire binding bevatten, is het moleculaire dipoolmoment slechts de vectorcombinatie van wat kan worden beschouwd als individuele “bindingsdipoolmomenten”. Wiskundig gezien zijn dipoolmomenten vectoren; zij bezitten zowel een magnitude als een richting. Het dipoolmoment van een molecuul is dus de vectorsom van de dipoolmomenten van de afzonderlijke bindingen in het molecuul. Als de afzonderlijke dipoolmomenten van de bindingen elkaar opheffen, is er geen netto dipoolmoment. Dat is het geval voor CO2, een lineair molecuul (figuur 1a). Elke C-O binding in CO2 is polair, maar experimenten tonen aan dat het CO2 molecuul geen dipoolmoment heeft. Omdat de twee C-O bindingsdipolen in CO2 even groot zijn en 180° ten opzichte van elkaar georiënteerd, heffen ze elkaar op. Dientengevolge heeft het CO2-molecuul geen netto dipoolmoment, hoewel het een aanzienlijke ladingsscheiding heeft. Het H2O-molecuul daarentegen is niet lineair (figuur); het is gebogen in de driedimensionale ruimte, zodat de dipoolmomenten elkaar niet opheffen. Een molecuul als H2O heeft dus een netto dipoolmoment. We verwachten dat de concentratie van negatieve lading op de zuurstof zit, het meest elektronegatieve atoom, en positieve lading op de twee hydrogenen. Door deze polarisatie van de lading kan H2O waterstofbindingen aangaan met andere gepolariseerde of geladen soorten, waaronder andere watermoleculen.
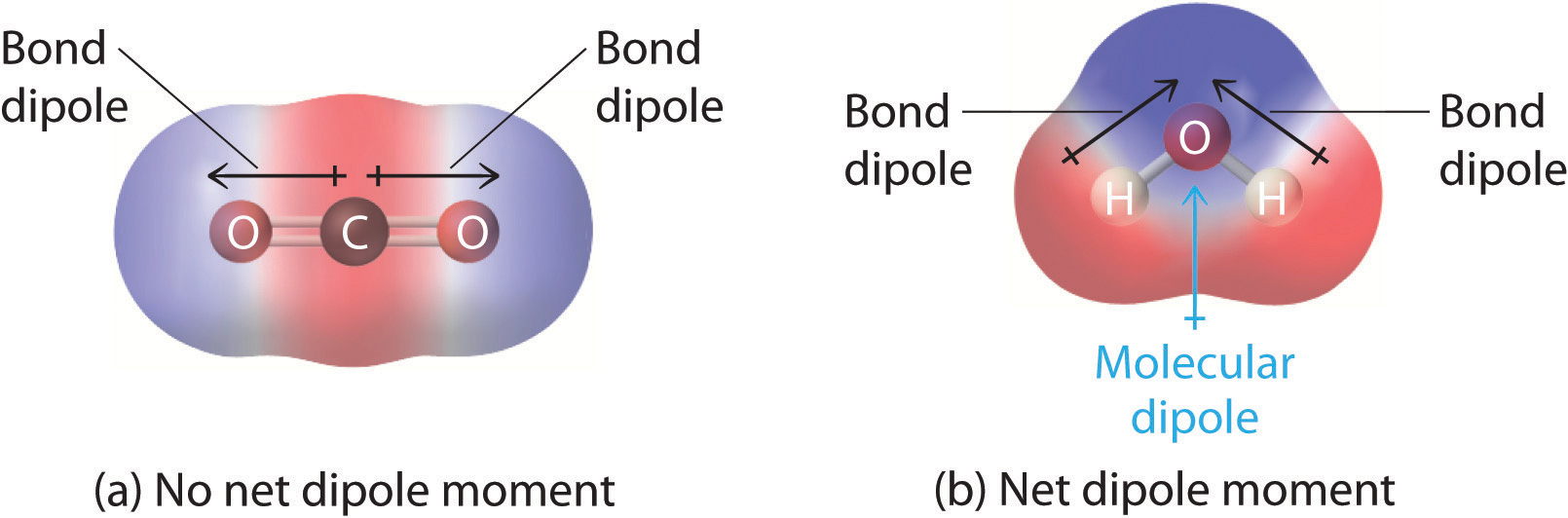
Figuur: Hoe de afzonderlijke dipoolmomenten van de bindingen bij elkaar worden opgeteld om een globaal moleculair dipoolmoment te verkrijgen voor twee triatomische moleculen met een verschillende structuur. (a) In CO2, zijn de C-O bindingsdipolen gelijk in grootte maar georiënteerd in tegengestelde richtingen (in 180°). Hun vectorsom is nul, dus CO2 heeft geen netto dipool. (b) In H2O zijn de dipolen van de O-H-bindingen ook gelijk in grootte, maar ze zijn georiënteerd in een hoek van 104,5° ten opzichte van elkaar. Vandaar dat de vectorsom niet nul is, en H2O een netto dipoolmoment heeft.
Het volgende is een vereenvoudigde vergelijking voor een eenvoudig gescheiden tweeladingsysteem dat voorkomt in diatomeeënmoleculen of wanneer men een bindingsdipool binnen een molecuul beschouwt.
De bindingsdipool, µ (Grieks mu) wordt geïnterpreteerd als de dipool van een ladingsscheiding over een afstand tussen de partiële ladingen ²(Q^+) en ²(Q^-) (of de meer algemeen gebruikte termen ²(δ^+) – ²(δ^-)); de oriëntatie van de dipool is langs de as van de binding. De eenheden voor dipoolmomenten zijn meestal debyes (D), waarbij één debye gelijk is aan 3,336 x 1030 coulombmeters (C – m) in SI-eenheden. Beschouw een eenvoudig systeem van een enkel elektron en proton, gescheiden door een vaste afstand. De eenheidslading van een elektron is 1,60 X 1019 C en het proton & elektron zijn 100 pm van elkaar verwijderd (ongeveer de lengte van een typische covalente binding), het dipoolmoment wordt berekend als:
&= (1,60 maal 10^{-19} C)(1,00 maal 10^{-10} m) \ &= 1,60 maal 10^{-29} \m
&= 4,80; D \label{3}
(4,80; D) is een belangrijke referentiewaarde en vertegenwoordigt een zuivere lading van +1 en -1 gescheiden door 100 pm. Echter, als de ladingscheiding wordt vergroot, neemt het dipoolmoment (lineair) toe:
- Als het proton en het elektron 120 pm van elkaar worden gescheiden:
- Als het proton en het elektron 150 pm gescheiden waren:
- Als het proton en het elektron 200 pm gescheiden waren:
- Als het proton en het elektron 200 pm gescheiden waren:
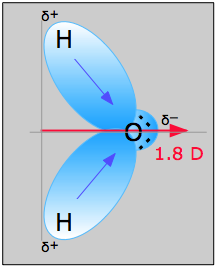
Het watermolecuul in figuur \(\PageIndex{1}\) kan worden gebruikt om de richting en de grootte van het dipoolmoment te bepalen. Uit de elektronegativiteiten van zuurstof en waterstof blijkt dat het verschil 1.2e is voor elk van de waterstof-zuurstof bindingen. Omdat zuurstof het meest elektronegatieve atoom is, oefent het een grotere aantrekkingskracht uit op de gedeelde elektronen; het heeft ook twee eenzame elektronenparen. Hieruit kan worden geconcludeerd dat het dipoolmoment van tussen de twee waterstofatomen naar het zuurstofatoom wijst. Met behulp van bovenstaande vergelijking wordt het dipoolmoment berekend op 1,85 D door de afstand tussen de zuurstof- en waterstofatomen te vermenigvuldigen met het onderlinge ladingsverschil en vervolgens de componenten van elk te vinden die wijzen in de richting van het netto dipoolmoment (de hoek van het molecuul is 104.5˚).
Het bindingsmoment van de O-H binding =1.5 D, dus het netto dipoolmoment is
Geef een antwoord