Pure Stoffen en Mengsels
Een zuivere chemische stof is elke materie die een vaste chemische samenstelling en karakteristieke eigenschappen heeft. Zuurstof, bijvoorbeeld, is een zuivere chemische stof die een kleurloos, reukloos gas is bij 25°C. Zeer weinig materiemonsters bestaan uit zuivere stoffen; in plaats daarvan zijn de meeste mengsels, dat zijn combinaties van twee of meer zuivere stoffen in variabele verhoudingen waarin de afzonderlijke stoffen hun identiteit behouden. Lucht, leidingwater, melk, blauwe kaas, brood, en vuil zijn allemaal mengsels. Als alle delen van een materiaal zich in dezelfde toestand bevinden, geen zichtbare grenzen hebben, en overal gelijk zijn, dan is het materiaal homogeen. Voorbeelden van homogene mengsels zijn de lucht die we inademen en het leidingwater dat we drinken. Homogene mengsels worden ook wel oplossingen genoemd. Zo is lucht een oplossing van stikstof, zuurstof, waterdamp, kooldioxide en verschillende andere gassen; leidingwater is een oplossing van kleine hoeveelheden van verschillende stoffen in water. De specifieke samenstelling van beide oplossingen ligt echter niet vast, maar hangt af van zowel de bron als de plaats; zo is de samenstelling van kraanwater in Boise, Idaho, niet dezelfde als die van kraanwater in Buffalo, New York. Hoewel de meeste oplossingen die we tegenkomen vloeibaar zijn, kunnen oplossingen ook vast zijn. De grijze stof die nog steeds door sommige tandartsen wordt gebruikt om gaatjes in tanden te vullen, is een complexe vaste oplossing die voor 50% uit kwik bestaat en voor 50% uit een poeder dat voornamelijk zilver, tin en koper bevat, met kleine hoeveelheden zink en kwik. Vaste oplossingen van twee of meer metalen worden gewoonlijk legeringen genoemd.
Als de samenstelling van een materiaal niet volledig uniform is, dan is het heterogeen (b.v. chocolate chip koekjesdeeg, blauwe kaas, en vuil). Mengsels die homogeen lijken, blijken na microscopisch onderzoek vaak heterogeen te zijn. Melk, bijvoorbeeld, lijkt homogeen, maar wanneer het onder een microscoop wordt onderzocht, bestaat het duidelijk uit kleine vet- en eiwitbolletjes die in water zijn verspreid. De bestanddelen van heterogene mengsels kunnen meestal met eenvoudige middelen worden gescheiden. Mengsels van vaste stoffen en vloeistoffen, zoals zand in water of theebladeren in thee, kunnen gemakkelijk worden gescheiden door filtratie, waarbij het mengsel door een barrière wordt geleid, zoals een zeef, met gaten of poriën die kleiner zijn dan de vaste deeltjes. In principe kunnen mengsels van twee of meer vaste stoffen, zoals suiker en zout, worden gescheiden door microscopische inspectie en sortering. Meestal zijn echter complexere bewerkingen nodig, zoals bij het scheiden van goudklompjes uit riviergrind door middel van pannen. Eerst wordt vast materiaal uit het rivierwater gefilterd; vervolgens worden de vaste stoffen door inspectie gescheiden. Als goud in gesteente is ingebed, moet het eventueel met chemische methoden worden geïsoleerd.
-and-Milk-(left).jpg?revision=1)
Figuur 1.2.2: Een heterogeen mengsel. Onder een microscoop is volle melk eigenlijk een heterogeen mengsel van vet- en eiwitbolletjes die in water zijn verspreid. Figuur gebruikt met toestemming van Wikipedia
Homogene mengsels (oplossingen) kunnen worden gescheiden in hun samenstellende stoffen door fysische processen die berusten op verschillen in een of andere fysische eigenschap, zoals verschillen in hun kookpunten. Twee van deze scheidingsmethoden zijn destillatie en kristallisatie. Bij destillatie wordt gebruik gemaakt van verschillen in vluchtigheid, een maat voor het gemak waarmee een stof bij een bepaalde temperatuur in een gas wordt omgezet. Een eenvoudig destillatietoestel voor het scheiden van een mengsel van stoffen, waarvan ten minste één een vloeistof is. Het meest vluchtige bestanddeel kookt het eerst en wordt in de watergekoelde condensor teruggecondenseerd tot een vloeistof, van waaruit het in de opvangkolf stroomt. Wanneer bijvoorbeeld een oplossing van zout en water wordt gedestilleerd, verzamelt de vluchtigste component, zuiver water, zich in de opvangkolf, terwijl het zout in de destillatiekolf blijft.

Figuur 1.2.3: De destillatie van een oplossing van keukenzout in water. De oplossing van zout in water wordt in de destillatiekolf verwarmd tot het kookt. De resulterende damp is verrijkt met de meer vluchtige component (water), die in de koude condensor condenseert tot een vloeistof en vervolgens wordt opgevangen in de opvangkolf.
Mengsels van twee of meer vloeistoffen met verschillende kookpunten kunnen worden gescheiden met een complexer destillatietoestel. Een voorbeeld is de raffinage van ruwe aardolie tot een reeks nuttige producten: vliegtuigbrandstof, benzine, kerosine, dieselbrandstof en smeerolie (in de volgorde van afnemende vluchtigheid). Een ander voorbeeld is de distillatie van alcoholische dranken zoals brandy of whisky. Deze betrekkelijk eenvoudige procedure bezorgde de federale autoriteiten in de jaren 1920 tijdens het tijdperk van de Drooglegging meer dan wat hoofdbrekens, toen illegale distilleerketels in afgelegen streken van de Verenigde Staten welig tierden.
Kristallisatie scheidt mengsels op basis van verschillen in oplosbaarheid, een maatstaf voor hoeveel vaste stof opgelost blijft in een gegeven hoeveelheid van een bepaalde vloeistof. De meeste stoffen zijn beter oplosbaar bij hogere temperaturen, zodat een mengsel van twee of meer stoffen bij een hoge temperatuur kan worden opgelost en dan langzaam kan afkoelen. Als alternatief kan men de vloeistof, het oplosmiddel genaamd, laten verdampen. In beide gevallen vormt de minst oplosbare van de opgeloste stoffen, degene die het minst waarschijnlijk in oplossing zal blijven, gewoonlijk het eerst kristallen, en deze kristallen kunnen door filtratie uit de overblijvende oplossing worden verwijderd.

Figuur 1.2.4: De kristallisatie van natriumacetaat uit een geconcentreerde oplossing van natriumacetaat in water. Door toevoeging van een klein “zaad”-kristal (a) vormt de verbinding witte kristallen, die groeien en uiteindelijk het grootste deel van de kolf in beslag nemen. De video kan hier worden gevonden: https://www.youtube.com/watch?v=BLq5NibwV5g
De meeste mengsels kunnen worden gescheiden in zuivere stoffen, die ofwel elementen ofwel verbindingen kunnen zijn. Een element, zoals grijs, metallisch natrium, is een stof die niet door chemische veranderingen kan worden gesplitst in eenvoudiger stoffen; een verbinding, zoals wit, kristallijn natriumchloride, bevat twee of meer elementen en heeft chemische en fysische eigenschappen die gewoonlijk verschillen van die van de elementen waaruit zij is samengesteld. Op enkele uitzonderingen na heeft een bepaalde verbinding dezelfde elementaire samenstelling (dezelfde elementen in dezelfde verhoudingen), ongeacht de herkomst of geschiedenis ervan. De chemische samenstelling van een stof wordt gewijzigd in een proces dat een chemische verandering wordt genoemd. De omzetting van twee of meer elementen, zoals natrium en chloor, in een chemische verbinding, natriumchloride, is een voorbeeld van een chemische verandering, die vaak een chemische reactie wordt genoemd. Momenteel zijn er ongeveer 115 elementen bekend, maar uit deze 115 elementen zijn miljoenen chemische verbindingen bereid. De bekende elementen zijn opgenomen in het periodiek systeem.
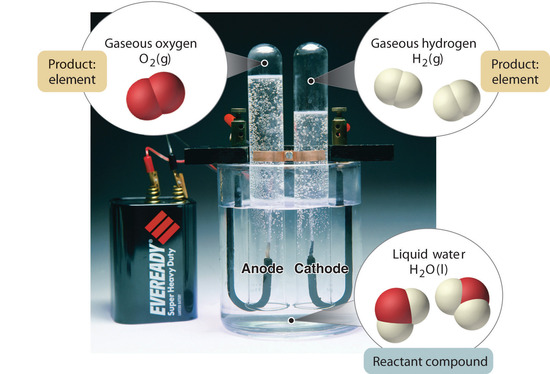
Figuur 1.2.5: De ontleding van water tot waterstof en zuurstof door elektrolyse. Water is een chemische verbinding; waterstof en zuurstof zijn elementen.
In het algemeen worden verbindingen in een omgekeerd chemisch proces afgebroken tot hun elementen. Bijvoorbeeld, water (een verbinding) kan worden ontleed in waterstof en zuurstof (beide elementen) door een proces dat elektrolyse wordt genoemd. Bij elektrolyse levert elektriciteit de energie die nodig is om een verbinding te scheiden in haar samenstellende elementen (figuur 1.2.5). Een soortgelijke techniek wordt op grote schaal gebruikt om zuiver aluminium, een element, te verkrijgen uit zijn ertsen, die mengsels van verbindingen zijn. Omdat voor elektrolyse veel energie nodig is, vormen de elektriciteitskosten verreweg de grootste kostenpost bij de produktie van zuiver aluminium. Het recycleren van aluminium is dus zowel rendabel als ecologisch verantwoord. De algemene organisatie van de materie en de methoden die worden gebruikt om mengsels te scheiden zijn samengevat in figuur 1.2.6.
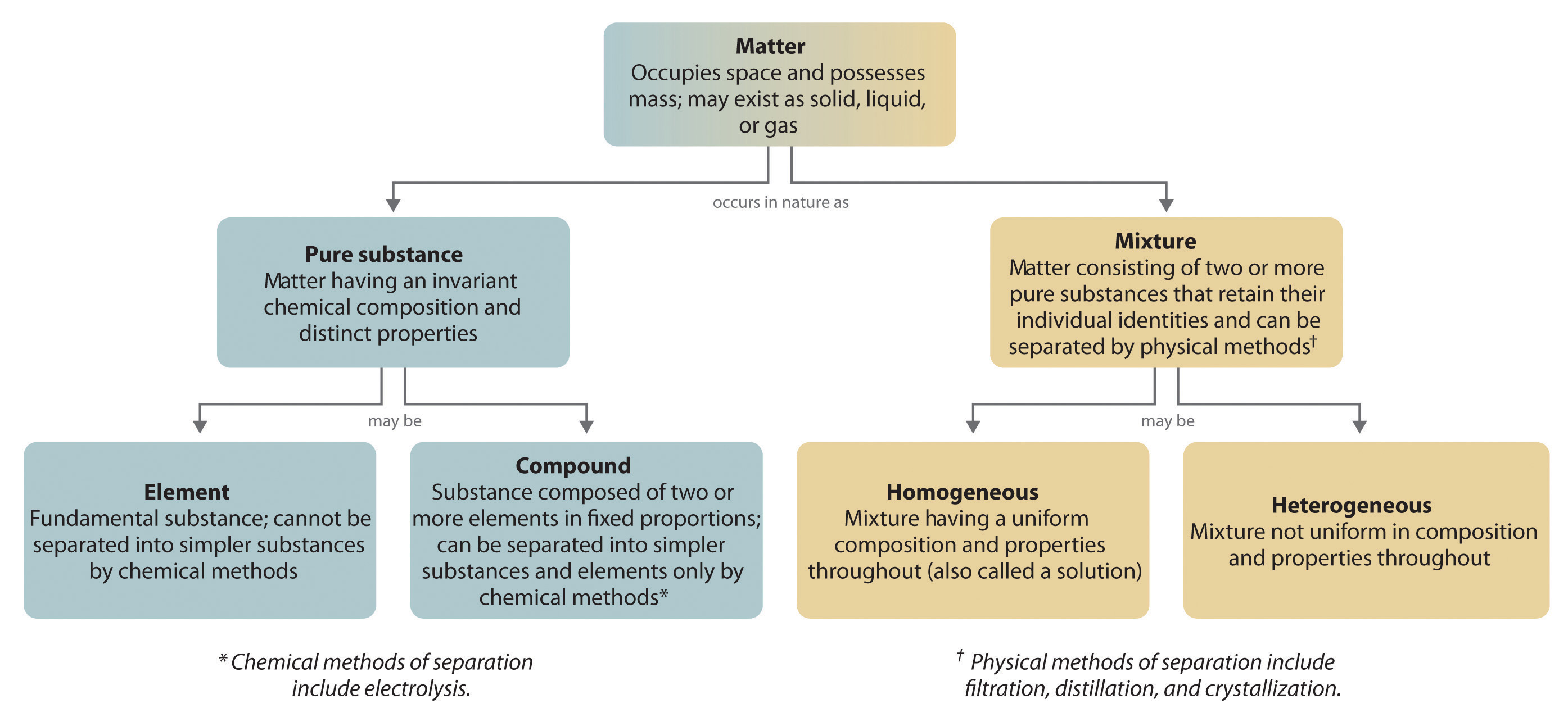
Figuur 1.2.6: Relaties tussen de soorten materie en de gebruikte methoden om mengsels te scheiden
Voorbeeld 1.2.1
Identificeer elke stof als een verbinding, een element, een heterogeen mengsel, of een homogeen mengsel (oplossing).
- gefilterde thee
- frisgeperst sinaasappelsap
- een compact disc
- aluminiumoxide, een wit poeder dat een 2:Verhouding aluminium en zuurstofatomen
- selenium
Gegeven: een chemische stof
Vraag: de classificatie
Strategie:
- Bepaal of een stof chemisch zuiver is. Als de stof zuiver is, is het ofwel een element ofwel een verbinding. Als een stof kan worden gescheiden in zijn elementen, is het een verbinding.
- Als een stof chemisch niet zuiver is, is het ofwel een heterogeen mengsel ofwel een homogeen mengsel. Als de samenstelling overal gelijk is, is het een homogeen mengsel.
Oplossing:
- Een thee is een oplossing van verbindingen in water, en is dus niet chemisch zuiver. Het wordt gewoonlijk van de theebladeren gescheiden door filtratie. B Omdat de samenstelling van de oplossing overal gelijk is, is het een homogeen mengsel.
- A Sinaasappelsap bevat zowel vaste (pulp) als vloeibare deeltjes; het is niet chemisch zuiver. B Omdat de samenstelling niet overal gelijk is, is sinaasappelsap een heterogeen mengsel.
- A Een compact disc is een vast materiaal dat meer dan één element bevat, waarbij langs de rand gebieden van verschillende samenstellingen zichtbaar zijn. Een compact disc is dus chemisch niet zuiver. B De gebieden van verschillende samenstelling geven aan dat een compact disc een heterogeen mengsel is.
- A Aluminiumoxide is een enkelvoudige, chemisch zuivere verbinding.
- A Selenium is een van de bekende elementen.
Oefening 1.2.1
Identificeer elke stof als een verbinding, een element, een heterogeen mengsel, of een homogeen mengsel (oplossing).
- witte wijn
- kwik
- salade dressing
- tafelsuiker (sacharose)
Antwoord:
- oplossing
- element
- heterogeen mengsel
- samenstelling
samenvatting
Materie kan worden ingedeeld op grond van fysische en chemische eigenschappen. Materie is alles wat ruimte inneemt en massa heeft. De drie toestanden van materie zijn vast, vloeibaar en gas. Een fysische verandering is de omzetting van een stof van de ene toestand van materie in een andere, zonder dat de chemische samenstelling verandert. De meeste materie bestaat uit mengsels van zuivere stoffen, die homogeen (uniform van samenstelling) of heterogeen (verschillende gebieden hebben verschillende samenstellingen en eigenschappen) kunnen zijn. Zuivere stoffen kunnen chemische verbindingen of elementen zijn. Verbindingen kunnen door chemische reacties worden afgebroken tot elementen, maar elementen kunnen niet met chemische middelen worden gescheiden in eenvoudiger stoffen. De eigenschappen van stoffen kunnen worden ingedeeld in fysische of chemische eigenschappen. Wetenschappers kunnen fysische eigenschappen waarnemen zonder de samenstelling van de stof te veranderen, terwijl chemische eigenschappen de neiging van een stof beschrijven om chemische veranderingen (chemische reacties) te ondergaan die de chemische samenstelling veranderen. Fysische eigenschappen kunnen intensief of extensief zijn. Intensieve eigenschappen zijn hetzelfde voor alle monsters; hangen niet af van de grootte van het monster; en omvatten, bijvoorbeeld, kleur, fysische toestand, en smelt- en kookpunten. Uitgebreide eigenschappen hangen af van de hoeveelheid materiaal en omvatten massa en volume. De verhouding van twee uitgebreide eigenschappen, massa en volume, is een belangrijke intensieve eigenschap die dichtheid wordt genoemd.
Bijdragers
Gewijzigd door Joshua Halpern (Howard University)
Geef een antwoord