Ben Valsler
Nu tot ce strălucește este aur,
de multe ori ați auzit asta.
Brian Clegg arată o altă față,
a aurului prostesc – sulfura de fier.
Brian Clegg
‘There’s gold in them thar hills!’ (Există aur în acele dealuri!). Sau există? După cum sugerează porecla sa de „aurul proștilor”, forma minerală pirita de disulfură de fier II are mai mult decât o asemănare trecătoare cu metalul prețios. Cu formula simplă FeS2, structura cubică a compusului poate duce la producerea unor forme platonice cu aspect remarcabil de eficient, atât sub formă de cuburi cu margini clare, cât și sub formă de dodecaedre care arată ca și cum ar fi fost fabricate, deși cel mai adesea formarea naturală are ca rezultat o structură mai puțin clar delimitată.

Sursa: ©
În cristalele de disulfură de fier, atomii de sulf vin în perechi, cu una dintre cele patru legături ale sulfului legată de un alt atom de sulf. Aceste legături sunt rupte prin încălzire pentru a produce sulfură de fier II – FeS – și sulf. Acest proces este utilizat în producția de dioxid de sulf, atât pentru a utiliza gazul, de exemplu ca înălbitor pentru hârtie, cât și ca primă etapă pentru producerea acidului sulfuric. Mai recent, compusul, care este un semiconductor, și-a găsit o utilizare în bateriile litiu-fier, în care catodul este alcătuit din disulfură de fier: aceste baterii sunt compatibile din punct de vedere al tensiunii cu celulele tradiționale de 1,5 volți, dar au o durată de viață semnificativ mai lungă decât echivalentele alcaline.

Sursa: ©
Poate cea mai veche aplicație a disulfurii de fier a fost ca o alternativă la cremene în producerea de scântei – de unde și numele de pirita – și a fost adesea folosită în acest fel la primele pistoale. De asemenea, a fost folosită multă vreme la producerea sulfatului de fier, cunoscut în mod tradițional sub numele de vitriol verde. Disulfura de fier este încă folosită uneori în acest mod, deși cu mecanisme mai sofisticate decât abordarea tradițională de a lăsa o grămadă de pirita în ploaie și de a colecta lichidul care se scurge din ea.
Cum mineralul se oxidează, el degajă o cantitate destul de mare de căldură, ceea ce poate duce la explozii în minele de cărbune cu un conținut ridicat de sulf. Această tendință de a se oxida nu înseamnă, însă, că disulfura de fier II este întotdeauna închisă. Pirita lustruită a fost folosită în bijuterii încă din cele mai vechi timpuri, iar cristalele sale destul de întunecate (rareori au strălucirea aurului) au fost deosebit de la modă între sfârșitul anilor 1700 și începutul secolului al XX-lea.

Sursa: ©
Brățară din marcasită
În mod confuz, bijuteriile realizate din pirita se numesc bijuterii din marcasită – confuz pentru că există un mineral alternativ de disulfură de fier II numit marcasită, în care structura cubică este întinsă la ceea ce se numește formă ortorombică. Această formă este mai puțin potrivită pentru fabricarea pietrelor prețioase, deoarece este mai fragilă și se poate fărâmița. Numele bijuteriei (adesea pronunțat „marca-seet” în Marea Britanie) datează dintr-o perioadă în care toate formele mineralului erau cunoscute sub numele de marcasit.

Sursa: ©
Meralul marcasit
Cu toate acestea, disulfura de fier II nu este nicidecum singura modalitate de a combina fierul și sulful. Sulfura de fier II cu aspect mult mai puțin atrăgător este o substanță pestriță neagră, cu o structură octaedrică în jurul fierului. Compusul se formează destul de frecvent în urma descompunerii materiei organice, fie ca nămol negru în mlaștini, fie ca decolorarea întunecată a unui gălbenuș de ou prea gătit.
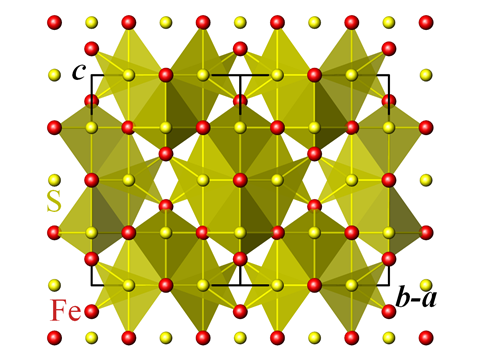
Sursa: Perditax
Structura cristalină a greigitului
Acest lucru este doar începutul pentru variantele subtile de sulfură de fier. Mineralele cunoscute sub numele de greigit, mackinawit și pirhotit au variante ale structurii, în timp ce pulberea neagră de sulfură de fier III – Fe2S3 – a fost produsă vreodată doar artificial. Greigitul se regăsește în abilitățile unui grup de bacterii marine descoperite abia în 1975, care au capacitatea remarcabilă de a se orienta în funcție de câmpul magnetic al Pământului. Denumite bacterii „magnetotactice”, aceste organisme au în celulele lor cristale formate în cea mai mare parte din greigit, care este echivalentul de sulfură de fier al celui mai bine cunoscut material magnetic natural, oxidul de fier magnetită.

Sursa: Raymond T. Downward, NASA
Suprafața gravată a meteoritului Mundrabilla, care arată o fază de aliaj metalic de fier-nichel din kamcite (38% Ni) și taenit (6% Ni) în dreapta jos, în stânga jos și în stânga sus. Materialul mai întunecat este o sulfură de fier (FeS sau troilit) cu un precipitat paralel de duabreelit (sulfură de fier-crom (FeCr2S4).
Poate cea mai interesantă dintre structurile alternative este troilitul, o altă formă de sulfură de fier cu o structură hexagonală. Deși aceasta se găsește ocazional nativă pe Pământ, ea apare cel mai frecvent în meteoriți – în special în varietățile relativ neobișnuite care își au originea pe Lună și pe Marte înainte de a fi aruncate de la suprafață în urma unui impact din spațiu.

Numele de troilit a fost dat în onoarea preotului italian Domenico Troili care a făcut prima observație înregistrată a unui meteorit care a avut ca rezultat un obiect care a lovit solul în 1766. Troili a crezut că materialul principal al meteoritului era marcasitul (probabil însemnând pirita), dar aproape 100 de ani mai târziu mineralogistul german Gustav Rose a identificat compoziția meteoritului ca fiind o sulfură de fier diferită și l-a numit după Troili.
Sulfura de fier poate fi o pacoste. Se poate acumula, de exemplu, în puțurile de petrol și gaze, îmbâcsind tubulatura. Cu toate acestea, în alte părți și-a dovedit utilitatea. Poate că este un compus simplu din două elemente chimice simple și, ca și pirita, un aur fals înșelător, dar în formele sale variate arată o diversitate și o adaptabilitate care îi face pe utilizatorii săi orice altceva decât proști.
Ben Valsler
Acesta a fost Brian Clegg în apărarea sulfurii de fier. Săptămâna viitoare, Mike Freemantle cu kerosenul și o formă neconvențională de război.
Michael Freemantle
La aproximativ o lună după atacul japonez asupra Pearl Harbor din decembrie 1941, un dentist american a venit cu un plan de a demola orașele japoneze prin legarea unor mici bombe incendiare de lilieci.
Ben Valsler
Descoperiți ce s-a întâmplat în Proiectul X-ray data viitoare. Până atunci, puteți trimite un e-mail la [email protected] sau un tweet la @chemistryworld dacă aveți cereri de compuși pe care ar trebui să îi includem în podcast. Sunt Ben Valsler, vă mulțumesc că sunteți alături de mine
.
Lasă un răspuns