Structura Lewis a ionului carbonat este desenată în acest tutorial pas cu pas. Conceptul de electroni de valență totală este utilizat pentru a desena structura lewis a CO32-. După ce se termină structura lewis a CO32-, ar trebui să existe o sarcină -2 și o stabilitate. Veți învăța despre aceste lucruri în acest tutorial.
- Ion carbonat | CO32-
- CO32- Structura Lewis
- Etapele desenării structurii lewis a ionului CO32-
- Numărul total de electroni din straturile de valență ale CO32-
- Total perechi de electroni de valență
- Actomul central al ionului CO32-
- Perechi singure pe atomi
- Carcini pe atomi
- Verificați stabilitatea și minimizați sarcinile pe atomi prin transformarea perechilor solitare în legături
- Structura lewis a ionului CO32- (carbonat)
- Structura lewis a carbonatului și structura lewis a bicarbonatului
Ion carbonat | CO32-
Ion carbonat are o sarcină -2. Compușii carbonați metalici sunt comuni în lume. Ca exemplu poate fi dat CaCO3.
CO32- Structura Lewis
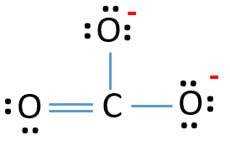
În structura Lewis a ionului CO32- există trei legături σ și o legătură π în jurul atomului de carbon.
Etapele desenării structurii lewis a ionului CO32-
Pentru a desena structura lewis a ionului CO32- sunt necesari următorii pași, care sunt explicați în detaliu în acest tutorial.
- Căutați numărul total de electroni din învelișurile de valență ale atomilor de carbon și oxigen
- Total perechi de electroni
- Selectarea atomului central
- Puneți perechile singuratice pe atomi
- Verificați stabilitatea și minimizați sarcinile pe atomi prin conversia perechilor singuratice în legături.
Desenarea corectă a structurii lewis este importantă pentru a desena corect structurile de rezonanță ale CO32-.
Numărul total de electroni din straturile de valență ale CO32-
Carbonul este situat în grupa 4 din tabelul periodic. Deci, carbonul are patru electroni în învelișul său de valență. oxigenul este situat la grupa a 6-a. Acesta are șase electroni în învelișul de valență.
- Total electroni de valență dați de atomul de carbon = 4
Există trei atomi de oxigen în ionul CO32-, Prin urmare
- Total electroni de valență dați de atomii de oxigen = 6 *3 = 18
Ionul CO32- are o sarcină de -2. Prin urmare, există încă doi electroni care contribuie la electronii de valență.
- Total electroni de valență = 4 + 18 + 2 = 24
Total perechi de electroni de valență
Total perechi de electroni de valență = legături σ + legături π + perechi solitare la straturile de valență
Total perechi de electroni se determină prin împărțirea numărului total de electroni de valență la doi. Pentru, ionul CO32-, perechile totale de electroni sunt 12.
Actomul central al ionului CO32-
Pentru a fi atomul central, este importantă capacitatea de a avea o valență mai mare. Carbonul are mai multe șanse de a fi atomul central (Vezi figura) deoarece carbonul poate prezenta valența 4. Valența cea mai mare a oxigenului este 2. Deci, acum putem construi o schiță a ionului CO32-.
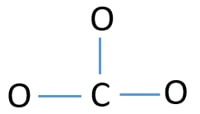
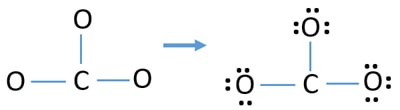
Perechi singure pe atomi
- În schița de mai sus există deja trei legături C-O. Prin urmare, au mai rămas doar nouă (12-3 = 9) perechi de electroni de valență.
- În primul rând, marcați aceste nouă perechi de electroni de valență ca perechi solitare în atomi externi (pe atomii de oxigen). Un atom de oxigen va lua trei perechi de electroni solitari conform regulii octale (atomul de oxigen nu poate păstra mai mult de opt electroni în învelișul său de valență).
- Pentru trei atomi de oxigen, se cheltuiesc nouă perechi de electroni. Acum nu mai sunt perechi solitare de marcat pe atomii de carbon după ce am marcat pe atomii de oxigen (în afara atomilor).
Carcini pe atomi
După, marcarea perechilor de electroni pe atomi, trebuie să marcăm sarcinile fiecărui atom. Marcarea sarcinilor este importantă deoarece este folosită pentru a determina cea mai bună structură lewis a ionului. După marcarea sarcinilor, veți vedea, fiecare atom de oxigen va primi o sarcină -1 și atomul de carbon va primi o sarcină +1.
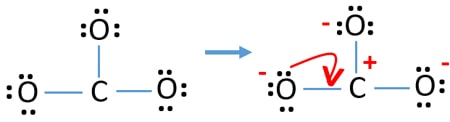
Verificați stabilitatea și minimizați sarcinile pe atomi prin transformarea perechilor solitare în legături
- Atomii de oxigen ar trebui să dețină sarcini negative deoarece electronegativitatea atomului de oxigen este mai mare decât cea a atomului de carbon. Altfel, putem spune că abilitatea de a reține sarcini negative este mai mare la atomii de oxigen decât la atomii de carbon.
- Structura desenată nu este una stabilă deoarece toți atomii au o sarcină (structura Lewis ar trebui să fie una stabilă cu mai puține sarcini).
- Acum, ar trebui să încercăm să minimizăm sarcinile prin convertirea perechii sau perechilor singuratice în legături. Deci, să convertim o pereche singuratică a unui atom de oxigen pentru a face o legătură C-O.
- Acum există o legătură dublă între atomul de carbon și un atom de oxigen (o legătură C=O). Acum, există două legături simple între atomul de carbon și ceilalți doi atomi de oxigen (două legături C-O).
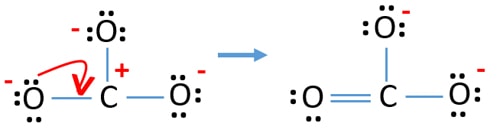
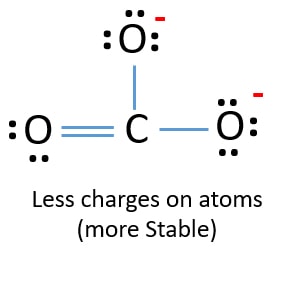
În noua structură, sarcinile atomilor sunt reduse față de structura anterioară. Acum nu mai există sarcini pe un atom de oxigen și pe atomul de carbon. De asemenea, doar doi atomi de oxigen au sarcini negative -1. Acum înțelegeți că această structură a CO32- este mai stabilă decât structura anterioară. Așadar, această structură are mai multe șanse să fie structura lewis a ionului CO32-.
Structura lewis a ionului CO32- (carbonat)
Întrebări
Puneți întrebările dumneavoastră de chimie și găsiți răspunsurile
Structura lewis a carbonatului și structura lewis a bicarbonatului
În ionul carbonat, există doi atomi de oxigen care au sarcină -1 pe fiecare dintre ei. Unul dintre acești atomi de oxigen preia un proton (ion H+) și formează o grupare -OH.
Tutoriale înrudite
.
Lasă un răspuns