|
|
Acest articol are mai multe probleme. Vă rugăm să ajutați la îmbunătățirea lui sau să discutați aceste probleme pe pagina de discuții. (Aflați cum și când să eliminați aceste mesaje din șablon)
(Aflați cum și când să eliminați acest mesaj șablon) |
Monosacaridele (de la grecescul monos: simplu, sacchar: zahăr), numite și zaharuri simple, sunt cea mai simplă formă de zahăr și cele mai de bază unități (monomeri) ale carbohidraților. Formula generală este C
nH
2nO
n, deși nu toate moleculele care se încadrează în această formulă (de exemplu, acidul acetic) sunt carbohidrați. Aceștia sunt de obicei solizi incolori, solubili în apă și cristalini. Contrar denumirii lor (zaharuri), numai unele monosacaride au un gust dulce.
Exemple de monosacaride includ glucoza (dextroza), fructoza (levuloza) și galactoza. Monozaharidele sunt elementele constitutive ale dizaharidelor (cum ar fi zaharoza și lactoza) și ale polizaharidelor (cum ar fi celuloza și amidonul). Fiecare atom de carbon care susține o grupare hidroxil este chiral, cu excepția celor de la capătul lanțului. Acest lucru dă naștere la o serie de forme izomere, toate cu aceeași formulă chimică. De exemplu, galactoza și glucoza sunt ambele aldohexosze, dar au structuri fizice și proprietăți chimice diferite.
Glucoza monosacaridică joacă un rol esențial în metabolism, unde energia chimică este extrasă prin glicoliză și prin ciclul acidului citric pentru a furniza energie organismelor vii. Unele alte monosacaride pot fi transformate în organism viu în glucoză.
Structură și nomenclatură
Cu câteva excepții (de exemplu, deoxiriboza), monosacaridele au această formulă chimică: (CH2O)x, unde convențional x ≥ 3. Monozaharidele pot fi clasificate în funcție de numărul x de atomi de carbon pe care îl conțin: trioză (3), tetroză (4), pentoză (5), hexoză (6), heptoză (7) și așa mai departe.
Glucoza, utilizată ca sursă de energie și pentru sinteza amidonului, glicogenului și celulozei, este o hexoză. Riboza și deoxiriboza (în ARN și, respectiv, ADN) sunt zaharuri pentozice. Printre exemplele de heptoses se numără cetozele, mannoheptuloza și sedoheptuloza. Monozaharidele cu opt sau mai mulți carboni sunt rareori observate, deoarece sunt destul de instabile. În soluțiile apoase, monosaharidele există sub formă de inele dacă au mai mult de patru atomi de carbon.
Monozaharide cu lanț liniar
Monozaharidele simple au un schelet de carbon liniar și neramificat, cu o grupare funcțională carbonil (C=O) și o grupare hidroxil (OH) pe fiecare dintre atomii de carbon rămași. Prin urmare, structura moleculară a unei monosacaride simple poate fi scrisă ca H(CHOH)n(C=O)(CHOH)mH, unde n + 1 + m = x; astfel încât formula sa elementară este CxH2xOx.
Prin convenție, atomii de carbon sunt numerotați de la 1 la x de-a lungul scheletului vertebral, începând de la capătul cel mai apropiat de grupul C=O. Monozaharidele sunt cele mai simple unități de carbohidrați și cea mai simplă formă de zahăr.
Dacă carbonilul se află în poziția 1 (adică n sau m este zero), molecula începe cu o grupare formil H(C=O)- și este, din punct de vedere tehnic, o aldehidă. În acest caz, compusul se numește aldoză. În caz contrar, molecula are o grupare ceto, un grup carbonil -(C=O)- între două atomi de carbon; în acest caz, este în mod formal o cetonă și se numește cetoză. Cetozele de interes biologic au, de obicei, carbonilul în poziția 2.
Diferitele clasificări de mai sus pot fi combinate, rezultând denumiri precum „aldohexoză” și „cetotrioză”.
O nomenclatură mai generală pentru monosacaridele cu lanț deschis combină un prefix grecesc pentru a indica numărul de carboni (tri-, tetr-, pent-, hex-, etc.) cu sufixele „-ose” pentru aldoze și „-ulose” pentru cetoze. În acest din urmă caz, dacă carbonilul nu se află în poziția 2, poziția sa este atunci indicată printr-un infix numeric. Astfel, de exemplu, H(C=O)(CHOH)4H este pentoză, H(CHOH)(C=O)(CHOH)3H este pentoză, iar H(CHOH)2(C=O)(CHOH)2H este pent-3-uloză.
Stereoisomeri cu lanț deschis
Două monosaharide cu grafii moleculare echivalente (aceeași lungime a lanțului și aceeași poziție a carbonilului) pot fi totuși stereoisomeri distincți, ale căror molecule diferă în orientarea spațială. Acest lucru se întâmplă numai dacă molecula conține un centru stereogenic, mai exact un atom de carbon care este chiral (conectat la patru sub-structuri moleculare distincte). Aceste patru legături pot avea oricare dintre cele două configurații în spațiu care se disting prin mâna lor. Într-o monosacaridă simplă cu lanț deschis, fiecare atom de carbon este chiral, cu excepția primului și ultimului atom din lanț și (în cetoze) a carbonului cu gruparea ceto.
De exemplu, tricetosa H(CHOH)(C=O)(CHOH)H (glicerona, dihidroxiacetona) nu are un centru stereogenic și, prin urmare, există ca un singur stereoisomer. Cealaltă trioză, aldoza H(C=O)(CHOH)2H (gliceraldehida), are un singur carbon chiral – cel central, numărul 2 – care este legat de grupurile -H, -OH, -C(OH)H2 și -(C=O)H. Prin urmare, ea există sub forma a doi stereoizomeri ale căror molecule sunt imagini în oglindă una a celeilalte (ca o mănușă stângă și una dreaptă). Monozaharidele cu patru sau mai mulți atomi de carbon pot conține mai mulți atomi de carbon chirali, astfel încât acestea au de obicei mai mult de doi stereoizomeri. Numărul de stereoizomeri distincți cu aceeași diagramă este delimitat de 2c, unde c este numărul total de carboni chirali.
Proiecția Fischer este o modalitate sistematică de a desena formula scheletică a unei monosacaride aciclice, astfel încât mâna fiecărui carbon chiral să fie bine specificată. Fiecare stereoizomer al unei monosacaride simple cu lanț deschis poate fi identificat prin pozițiile (dreapta sau stânga) în diagrama Fischer ale hidroxililor chirali (hidroxilii atașați la carbonații chirali).
Cei mai mulți stereoizomeri sunt ei înșiși chirali (diferiți de imaginile lor în oglindă). În proiecția Fischer, doi izomeri cu imagine în oglindă diferă prin faptul că pozițiile tuturor hidroxililor chirali sunt inversate de la dreapta la stânga. Izomerii cu imagine în oglindă sunt identici din punct de vedere chimic în medii nechirale, dar de obicei au proprietăți biochimice și apariții în natură foarte diferite.
În timp ce majoritatea stereoizomerilor pot fi aranjați în perechi de forme cu imagine în oglindă, există unii stereoizomeri nechirali care sunt identici cu imaginile lor în oglindă, în ciuda faptului că au centre chirale. Acest lucru se întâmplă ori de câte ori graficul molecular este simetric, ca în cazul 3-cetopentozelor H(CHOH)2(CO)(CHOH)2H, iar cele două jumătăți sunt imagini în oglindă una a celeilalte. În acest caz, oglindirea este echivalentă cu o rotație de jumătate de tură. Din acest motiv, există doar trei stereoizomeri distinși de 3-cettopenteză, chiar dacă molecula are doi carboni chirali.
Stereoizomerii distincți care nu sunt imagini în oglindă unul față de celălalt au de obicei proprietăți chimice diferite, chiar și în medii nechirale. Prin urmare, fiecărei perechi în oglindă și fiecărui stereoizomer nechiral i se poate da un nume specific de monosacaridă. De exemplu, există 16 stereoizomeri distinși de aldohexoză, dar denumirea „glucoză” desemnează o pereche specifică de aldohexoze în oglindă. În proiecția Fischer, unul dintre cei doi izomeri de glucoză are hidroxilul la stânga pe C3, și la dreapta pe C4 și C5; în timp ce celălalt izomer are modelul inversat. Aceste denumiri specifice ale monosacaridelor au abrevieri convenționale din trei litere, cum ar fi „Glu” pentru glucoză și „Thr” pentru treoză.
În general, o monosacaridă cu n carboni asimetrici are 2n stereoizomeri. Numărul de stereoizomeri de lanț deschis pentru o aldoză monosacaridă este mai mare cu unu decât cel al unei cetoze monosacaride de aceeași lungime. Fiecare cetoză va avea 2(n-3) stereoizomeri, unde n > 2 este numărul de atomi de carbon. Fiecare aldoză va avea 2(n-2) stereoizomeri, unde n > 2 este numărul de atomi de carbon.Aceștia sunt, de asemenea, denumiți epimeri, care au un aranjament diferit al grupărilor -OH și -H la atomii de carbon asimetrici sau chirali (acest lucru nu se aplică la acei carboni care au gruparea funcțională carbonil).
Configurația monosacaridelor
Ca multe molecule chirale, cei doi stereoizomeri ai gliceraldehidei vor roti treptat direcția de polarizare a luminii polarizate liniar pe măsură ce aceasta trece prin ea, chiar și în soluție. Cei doi stereoizomeri sunt identificați cu prefixele D- și L-, în funcție de sensul de rotație: D-gliceraldehida este dextrorotatorie (rotește axa de polarizare în sensul acelor de ceasornic), în timp ce L-gliceraldehida este levorotatorie (o rotește în sens invers acelor de ceasornic).

Prefixele D- și L- sunt folosite și cu alte monosacaride, pentru a distinge doi stereoisomeri particulari care sunt imagini în oglindă unul față de celălalt. În acest scop, se ia în considerare carbonul chiral care este cel mai îndepărtat de grupul C=O. Cele patru legături ale sale trebuie să se conecteze la -H, -OH, -C(OH)H și la restul moleculei. Dacă molecula poate fi rotită în spațiu astfel încât direcțiile acestor patru grupări să corespundă cu cele ale grupărilor analoge din D-gliceraldehida C2, atunci izomerul primește prefixul D-. În caz contrar, primește prefixul L-.
În proiecția Fischer, prefixele D- și L- specifică configurația la atomul de carbon care este al doilea de jos: D- dacă hidroxilul se află în partea dreaptă și L- dacă se află în partea stângă.
Rețineți că prefixele D- și L- nu indică direcția de rotație a luminii polarizate, care este un efect combinat al aranjamentului la toți centrele chirale. Cu toate acestea, cei doi enantiomeri vor roti întotdeauna lumina în direcții opuse, cu aceeași cantitate. A se vedea, de asemenea, sistemul D/L.
Ciclizarea monosacaridelor
O monosacaridă trece adesea de la forma aciclică (lanț deschis) la o formă ciclică, printr-o reacție de adiție nucleofilă între gruparea carbonil și unul dintre hidroxilii aceleiași molecule. Reacția creează un inel de atomi de carbon închis de un atom de oxigen de legătură. Molecula rezultată are o grupare hemiacetală sau hemicetală, în funcție de faptul că forma liniară a fost o aldoză sau o cetoză. Reacția este ușor de inversat, dând forma inițială cu lanț deschis.
În aceste forme ciclice, inelul are de obicei cinci sau șase atomi. Aceste forme se numesc furanoze și, respectiv, piranoze – prin analogie cu furanul și piranul, cei mai simpli compuși cu același inel carbon-oxigen (deși le lipsesc legăturile duble ale acestor două molecule). De exemplu, glucoza aldohexoza poate forma o legătură hemiacetală între hidroxilul de pe carbonul 1 și oxigenul de pe carbonul 4, rezultând o moleculă cu un inel cu 5 membri, numită glucofuranoză. Aceeași reacție poate avea loc între carbonii 1 și 5 pentru a forma o moleculă cu un inel cu 6 membri, numită glucopiranoză. Formele ciclice cu un inel cu șapte atomi (același ca și cel al oxepanului), rar întâlnite, se numesc heptose.


.

Pentru multe monosacaride (inclusiv glucoza), predomină formele ciclice, în stare solidă și în soluții și, prin urmare, se folosește în mod obișnuit aceeași denumire pentru izomerii cu lanț deschis și închis. Astfel, de exemplu, termenul „glucoză” poate însemna glucofuranoză, glucopiranoză, forma cu lanț deschis sau un amestec al celor trei.
Ciclarea creează un nou centru stereogenic la carbonul purtător de carbon. Grupul -OH care înlocuiește oxigenul carbonilului poate sfârși în două poziții distincte în raport cu planul median al inelului. Astfel, fiecare monosacaridă cu lanț deschis produce doi izomeri ciclici (anomeri), indicați prin prefixele α- și β-. Molecula se poate schimba între aceste două forme printr-un proces numit mutarotație, care constă într-o inversare a reacției de formare a inelului urmată de o altă formare a inelului.
Proiecția Haworth
Structura stereochimică a unei monosacaride ciclice poate fi reprezentată printr-o proiecție Haworth. În această diagramă, izomerul α pentru forma piranoză a unei D-aldohexose are -OH al carbonului anomeric sub planul atomilor de carbon, în timp ce izomerul β are -OH al carbonului anomeric deasupra planului. Piranozele adoptă de obicei o conformație de scaun, asemănătoare cu cea a ciclohexanului. În această conformație, izomerul α are -OH al carbonului anomeric în poziție axială, în timp ce izomerul β are -OH al carbonului anomeric în poziție ecuatorială (având în vedere zaharurile D-aldohexoză).
-
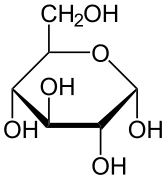
α-D-Glucopiranoză
-

β-.D-Glucopiranoză
Derivați
Există un număr mare de monosacaride modificate importante din punct de vedere biologic:
- Aminozaharuri, cum ar fi:
- galactosamina
- glucozamina
- acidul sialic
- N-acetilglucozamina
- Sulfosugari, cum ar fi:
- sulfoquinovioză
- Alții, cum ar fi:
- acidul ascorbic
- manitol
- acidul glucuronic
Vezi și
- Nomenclatura monozaharidelor
- Reducător al zahărului
- Acid zaharos
- Alcool zaharos
- Dizaharidă
.
Note
- ^ „Carbohidrați”. Chimie pentru biologi. Societatea Regală de Chimie. Retrieved 10 martie 2017.
- ^ NCERT TEXT BOOK CLaSS-12
- ^ „Carbohydrates”. Chemistry for Biologists (în engleză). Societatea Regală de Chimie. Recuperat la 10 martie 2017.
- ^ Pigman, William Ward; Anet, E. F. L. J. (1972). „Chapter 4: Mutarotations and Actions of Acids and Bases”. În Pigman și Horton (ed.). The Carbohydrates: Chemistry and Biochemistry (Chimie și biochimie). 1A (2nd ed.). San Diego: Academic Press. pp. 165-194.
- ^ IUPAC, Compendiu de terminologie chimică, ed. a 2-a, Ed. (the „Gold Book”) (1997). Versiune corectată online: (2006-) „Haworth representation”. doi:10.1351/goldbook.H02749
.


Lasă un răspuns