De la Proteopedia
proteopedia linkproteopedia link
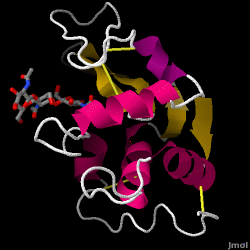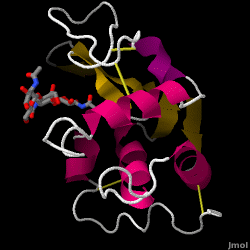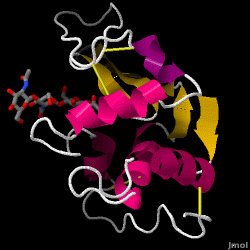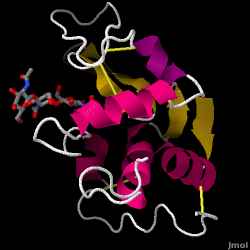
Lizozima – cunoscută și sub numele de muramidază – este o enzimă puternică care se găsește din abundență în lacrimi, salivă și lapte uman. La om, este codificată în gena LYZ. Deoarece este o proteină mică, ușor de obținut și foarte stabilă, a făcut obiectul unor cercetări extinse în ceea ce privește funcția și structura sa.
Introducere
Lizozima acționează ca o apărare nespecifică împotriva bacteriilor și ciupercilor. Este o componentă a sistemului imunitar înnăscut și este o parte importantă a dietei unui sugar pentru a se feri de diaree. Este o enzimă cunoscută pentru capacitatea sa de a degrada arhitectura polizaharidică a multor tipuri de pereți celulari, în mod normal în scopul protecției împotriva infecțiilor bacteriene. Structura lizozimei din albușul de ou de găină (HEW), care face obiectul acestui articol, este prezentată în dreapta. Activitatea antibacteriană a albușului de ou de găină a fost descrisă pentru prima dată de Laschtschenko în 1909. Aceasta a fost caracterizată și denumită „lizozimă” de Alexander Fleming, aceeași persoană căreia i se atribuie descoperirea penicilinei. Descoperirea activității enzimatice a fost un accident; în timpul unui experiment fără legătură între ele, secrețiile nazale au fost introduse din greșeală într-o farfurie Petri care conținea o cultură bacteriană, cultură care, în consecință, a prezentat rezultatele unei reacții enzimatice încă necunoscute. Observarea acestei reacții necunoscute a dus la continuarea cercetărilor privind componentele acestei reacții, precum și la identificarea corespunzătoare a „lizozimei” nou descoperite. În 1965, David C. Phillips și colaboratorii au determinat structura tridimensională a lizozimei la o rezoluție de 2 Å . Lucrarea lui Phillips a fost deosebit de revoluționară, deoarece Phillips reușise să elucideze cu succes structura unei enzime prin cristalografie cu raze X – o performanță care nu mai fusese realizată până atunci. Cercetările lui Phillips au condus, de asemenea, la o ipoteză bazată pe structură a mecanismului său de acțiune.
Funcția
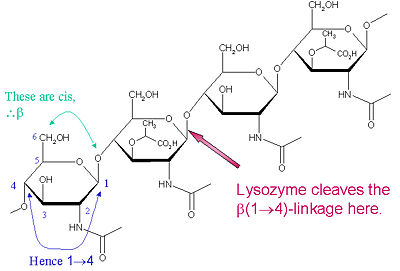
Substratul special de preferință pentru acest tip de clivaj este o hexasacaridă (NAG-NAM)₃, în cadrul căreia are loc legătura glicozidică țintă de clivaj, NAM₄-β-O-NAG₅. Unitățile individuale de legare a hexazacaridelor sunt desemnate de la A la F, preferința de scindare a legăturii glicozidice NAM₄-β-O-NAG₅ corespunzând unei legături glicozidice a unității D-E cl
Lizozimul este cunoscut pentru deteriorarea pereților celulari bacterieni prin catalizarea hidrolizei de 1,4-beta-legături între reziduurile de acid N-acetilmuramic (NAM) și N-acetil-D-glucozamină (NAG) din peptidoglican și între reziduurile de N-acetil-D-glucozamină din chitodextrine. În acest fel, lizozima este eficientă în liza pereților celulari atât ai bacteriilor, cât și ai ciupercilor. Locul de scindare pentru lizozim pe această temă arhitecturală este legătura glicozidică β(1-4) care leagă carbonul C1 al NAM de carbonul C4 al NAG.
Substratul special de preferință pentru acest tip de scindare este o hexacaridă (NAG-NAM)₃, în cadrul căreia are loc legătura glicozidică țintă de scindare, NAM₄-β-O-NAG₅. Unitățile individuale de legare a hexazacaridelor sunt denumite A-F, preferința de clivare a legăturii glicozidice NAM₄-β-O-NAG₅ corespunzând unei preferințe de clivare a legăturii glicozidice din unitatea D-E. În funcție de organismul de la care se obține lizozimul, hidroliza legăturii glicozidice are loc cu păstrarea configurației la carbonul anomeric (albuș de ou de găină) sau cu inversiune (gâscă, fagul T4).
Lizozimul acționează eficient asupra polimerilor lungi (NAG-NAM) sau (NAG). Pe măsură ce lungimea lanțului devine mai mică de șase monomeri, ratele catalitice scad substanțial; de fapt, trisacaridele acționează ca inhibitori competitivi prin legarea la situsul activ într-un registru neproductiv.
Hen albuș de ou lizozimă (cod PDB 1hew)
Mecanism
Hidroliza legăturilor glicozidice de către lizozima din albușul de ou de găină decurge cu păstrarea configurației. În 1953, Koshland a sugerat că, în general, reținerea configurației implică un mecanism de dublă deplasare (în timp ce inversarea configurației implică o singură deplasare). Timp de decenii, au fost luate în considerare două ipoteze mecaniciste concurente (Phillips: mecanism disociativ cu intermediar oxocarbeniu; Koshland: mecanism asociativ în două etape cu un complex enzimatic covalent ca intermediar), datele din 2001 înclinând balanța spre existența unui intermediar covalent. Absența unei structuri complexe de substrat a contribuit cu siguranță la dificultatea de a distinge între mecanismele posibile, la fel ca și existența a două mecanisme distincte (retenție și inversare de configurație) în cadrul aceleiași familii structurale de enzime (de ex. enzima de găină vs. enzima de gâscă).
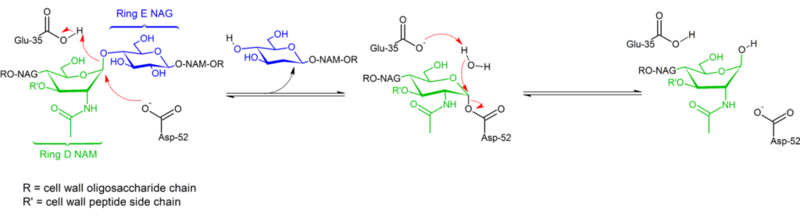
Lizozima hidrolizează o glicozidă (de unde și clasificarea familială a lizozimei ca glicozilază), ceea ce corespunde conversiei unui acetal într-un hemiacetal. Reacția se desfășoară în două etape, așa cum se arată în figura de mai sus. În prima etapă, Asp 52 acționează ca nucleofil, iar o parte din zahăr este grupa de plecare. În a doua etapă, apa acționează ca nucleofil, iar Asp 52 acționează ca grup de plecare. Ambele etape inversează configurația la nivelul carbonului anomeric, ceea ce duce la o păstrare globală a configurației. Glu 35 acționează ca un acid în prima etapă (protonând zahărul din legătura glicozidică pentru a-l transforma într-un electrofil mai bun) și ca o bază în a doua etapă (deprotonând apa pentru a o transforma într-un nucleofil mai bun). În timp ce figura prezintă unele dintre zaharuri într-o conformație de barcă pentru a sublinia inversarea configurației, acestea nu sunt observate experimental, ci se găsesc mai degrabă într-o conformație de scaun.
Aplicații ale lizozimei
Din moment ce lizozima a fost recunoscută pe scară largă pentru proprietățile sale antibacteriene și antifungice, aceasta are o mare varietate de utilizări atât în aplicații biochimice, cât și farmaceutice. În biologia moleculară, lizozima este adesea utilizată în procedura de liză alcalină pentru extragerea și izolarea ADN-ului plasmidic. Este utilizată pe scară largă în domeniul farmaceutic pentru distrugerea bacteriilor gram-pozitive și poate fi folosită pentru a susține apărarea imunitară deja existentă în vederea combaterii infecțiilor bacteriene. Această enzimă este deosebit de importantă pentru prevenirea bolilor bacteriene la sugari. Datorită proprietăților sale antibacteriene, lizozima poate fi utilizată și în industria alimentară pentru a ajuta la prevenirea deteriorării alimentelor.
Vezi și
- Structuri 3D ale lizozimei
- Lizozima
- Hidrolaze glicozidice de retenție
- Molecular Playground/Lizozimă
- Utilizator:Judy Voet/Lysozyme
- Lysozyme (arabă)
- Lysozyme (ebraică)
- Ragland SA, Criss AK. De la uciderea bacteriilor la modularea imunitară: Perspective recente asupra funcțiilor lizozimei. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming, A. (1922) On a remarkable bacteriolytic element found in tissues and secretions. Proc.Roy.Soc.(Londra),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structura lizozimei din albușul de ou de găină. O sinteză Fourier tridimensională la o rezoluție de 2 angstromi. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. An Introduction to Enzyme and Coenzyme Chemistry (O introducere în chimia enzimelor și coenzimelor). Blackwell Science Ltd., Oxford
- Primele soluții pentru structurile cristaline macromoleculare.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Studii cristalografice ale activității lizozimei din albușul de ou de găină. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Imagine din: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Desene de panglică timpurii ale proteinelor. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structura lizozimei din albușul de ou de găină. O sinteză Fourier tridimensională la o rezoluție de 2 angstromi. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Structura unor complecși cristalini de lizozime-inhibitori determinați prin analiză cu raze X la o rezoluție de 6 Angstrom. Nature. 1965 May 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. Cataliza de către lizozima din albușul de ou de găină procedează prin intermediul unui intermediar covalent. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers și Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski) https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Proteopedia Page Contributors and Editors (what is this?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
.
Lasă un răspuns