- Introducere
- Experimental
- Materiale
- Sinteza compușilor de intercalare
- Caracterizare
- Rezultate și discuții
- Caracterizare XRD
- Spectre FTIR
- Modelul structural al compușilor de intercalare Kaol/alchilamină
- Analiză termică
- Cinetica reacției de descompunere
- Concluzii
- Contribuții ale autorilor
- Declarație privind conflictul de interese
- Recunoștințe
Introducere
Proiectarea și fabricarea nanocompozitelor argilă/polimer au atras un interes ridicat atât din partea comunității științifice, cât și a celei inginerești (Cheng et al., 2017). O mare varietate de nanocompozite argilă/polimer au fost dezvoltate și sunt utilizate în aplicații pe scară largă (Gogoi și Raidongia, 2017). Preintercalarea argilelor urmată de încorporarea polimerilor în stratul de minerale argiloase este o abordare adoptată pe scară largă pentru prepararea nanocompozitelor argilă/polimer (Li et al., 2009; Zare et al., 2017). În timp ce sunt intercalate în straturile de argilă anorganică, lanțurile polimerice organice își reduc în mod natural mobilitatea structurală, iar unele dintre ele își asumă o conformație foarte organizată în cadrul structurii stratificate.
În natură, caolinitul (Kaol) este un tip de mineral de argilă cu o structură stratificată de silicat de aluminiu 1:1 dioctaedric 1:1 (Brindley și Robinson, 1945). Straturile din Kaol sunt ținute împreună prin legături de hidrogen, interacțiuni dipol-dipolare și forțe van der Waals (Brindley et al., 1967). Cu toate acestea, doar un număr limitat de specii organice foarte polare, inclusiv ureea (Makó et al., 2009), dimetilsulfoxidul (Costanzo și Giesse, 1986), formamida (Frost et al., 2000a), hidrazina (Cruz și Franco, 2000) și acetatul de potasiu (Frost et al., 2000b) au fost intercalate cu succes în galeria de Kaol. Intercalarea moleculelor mici în straturile de Kaol determină o creștere a spațiului bazal și poate fi utilizată ca o etapă preliminară de expansiune pentru inserția ulterioară a unor specii de dimensiuni mari, nereactive, prin deplasarea moleculelor mici preintercalate (Cheng et al., 2015). De exemplu, pe baza rapoartelor anterioare, un compus de intercalare Kaol/metanol poate fi un intermediar eficient pentru o reacție de intercalare ulterioară cu etilenglicol (Hirsemann et al., 2011), hexilamină (Matusik et al., 2012), n-alchilamine (Gardolinski și Lagaly, 2005) și săruri de amoniu cuaternar (Cheng et al., 2016). În plus, majoritatea moleculelor oaspete sunt dificil de inserat în spațiul interstratificat, unul dintre motive fiind legăturile puternice de hidrogen, altul fiind faptul că nu există ioni schimbabili în structura Kaol.
Deși nanocompozitele argilă/polimer au fost bine dezvoltate în ultimii ani, sintetizarea de noi nanocompozite argilă/organice pentru aplicații potențiale reprezintă încă o mare provocare (Kotal și Bhowmick, 2015). Pentru a rezolva această problemă, este cu adevărat o chestiune urgentă să ne dăm seama de procesul de intercalare a caolinitului la scară nanometrică și să facem o investigație amănunțită a mecanismului de descompunere cu ajutorul tehnologiei și instrumentelor analitice moderne. Analiza termică și calculul cinetic al compușilor de intercalare argilă/polimer pot contribui la caracterizarea proceselor de descompunere și pot oferi o bază științifică pentru controlul asupra reacțiilor de intercalare (Zhang et al., 2015). Parametrii cinetici ai procesului cinetic al reacției de descompunere, cum ar fi energia de activare, preexponențialul, ordinele de reacție și constanta de viteză, au fost evaluați cu ajutorul datelor din termogramele argilei/polimerului. În acest studiu, a fost investigată intercalarea Kaol cu diferite alchilamine. În plus, a fost investigat sistematic procesul de intercalare și mecanismul de descompunere.
Experimental
Materiale
Kaolinul utilizat în acest studiu a fost exploatat din Zhangjiakou, China. Compoziția minerală principală este un caolinit bine ordonat (95% în masă). A fost măcinat pentru a trece printr-o sită cu ochiuri de 325 (particule care măsoară < 44 μm) înainte de intercalare. Alchilamina hexilamină (HA, 99%), dodecilamină (DA, chimic pură) și octadecilamină (OA, chimic pură) au fost achiziționate de la Nanjing Shuguang Chemical Company, China. Sulfoxidul de dimetil (DMSO, reactiv analitic), metanolul (MeOH, reactiv analitic) și toluenul (99%) au fost primite de la Xilong Chemical Company, China, și au fost utilizate ca atare, fără alte purificări. Formula chimică și formula structurală a HA, DA și OA sunt prezentate în tabelul 1.

Tabel 1. Formula chimică și structurală a HA, DA și OA.
Sinteza compușilor de intercalare
În primul rând, compusul de intercalare Kaol/DMSO a fost preparat prin dispersarea a 20,0 g Kaol într-un amestec de 36,0 g DMSO și 4,0 g apă. Amestecul a fost agitat în baie de apă timp de 2 h la 95°C, iar apoi suspensia a fost separată prin centrifugare cu etanol. În al doilea rând, compusul de intercalare Kaol/DMSO a fost utilizat ca precursor pentru o reacție ulterioară cu MeOH. MeOH a fost adăugat la Kaol pre-intercalat și amestecul de reacție a fost agitat timp de 10 zile, MeOH fiind înlocuit în fiecare zi cu aceeași cantitate de MeOH proaspăt. Precipitatul din amestec a fost separat prin centrifugare și uscat într-un cuptor la 60°C timp de 12 ore pentru a obține compuși de intercalare Kaol/MeOH. În cele din urmă, 2 g de compus de intercalare Kaol/MeOH au fost amestecate cu 30,0 ml de soluții de metanol HA, DA sau OA (1 mol/L) prin agitare la temperatura ambiantă, respectiv. Dispersiile au fost centrifugate după reacție timp de 24 h. Sedimentele au fost spălate de trei ori cu toluen pentru a elimina excesul de HA, DA sau OA. Probele au fost uscate la temperatura camerei timp de 12 h și au fost măcinate în pulberi cu un mortar de agat (Komori et al., 1999). Compușii rezultați sunt etichetați ca fiind Kaolpi/HA (pi ca preintercalat), Kaolpi/DA și Kaolpi/OA.
Caracterizare
Programele XRD au fost înregistrate pe un difractometru de raze X Rigaku D/max 2500PC cu radiație Cu Kα (λ = 1,54178 Å) care funcționează la 40 kV și 150 mA. Eșantioanele orientate aleatoriu au fost scanate în intervalul 2θ între 1 și 20° la o viteză de 2° min-1. Un spectrofotometru Thermo Fisher Nicolet 6700 a fost utilizat pentru a înregistra spectrele FTIR în intervalul 4.000~400 cm-1. Analizele TG-DSC au fost efectuate cu un analizor termic simultan Mettler-Toledo TG-DSC I/1600 HT sub atmosferă de azot. Douăzeci de miligrame de probă au fost plasate într-un creuzet de alumină și au fost încălzite de la 30 la 1.100°C cu o serie de viteze de încălzire la 4, 6, 8, 10°C min-1.
Rezultate și discuții
Caracterizare XRD
Posturile XRD ale Kaol-ului pristin și ale compușilor săi de intercalare sunt prezentate în figura 1. Modelul Kaolului pristin prezintă o structură stratificată bine ordonată, cu o spațiere bazală de 0,71 nm. Această valoare se potrivește bine cu modelul de referință standard ICDD 14-0164 . După ce a fost tratat cu DMSO, a apărut un nou vârf de reflexie bazală la 1,14 nm, ceea ce indică faptul că DMSO a fost introdus cu succes în straturile intermediare Kaol. După ce compusul de intercalare Kaol/DMSO a fost tratat cu MeOH, caracteristica de reflexie de 1,14 nm (001) a compusului de intercalare Kaol/DMSO a fost deplasată la 0,86 nm. A fost raportat de Matusik et al. (2012) că, după ce compusul Kaol/DMSO/MeOH a fost uscat la 110°C, reflexia cu d = 1,12 nm a dispărut și a fost observată o reflexie largă cu un maxim la 0,95 nm. Pe baza formulei chimice Al2Si2O5(OH)3,20(OCH3)0,80 a compusului de intercalare Kaol/DMSO, care a fost calculată pe baza analizei CHNS, a arătat că aproximativ 1/3 din grupările OH de la suprafața interioară au fost înlocuite cu grupări metoxi, iar această observație sugerează, de asemenea, formarea unui compus de intercalare Kaol/MeOH (Tunney și Detellier, 1996; Cheng și colab., 2015). Modelele XRD arată, de asemenea, că compușii Kaol/MeOH intercalați cu HA, DA și OA extind structura de-a lungul axei c, ceea ce duce la o distanță mare între straturi de 2,86, 4,08 și, respectiv, 5,66 nm. Lungimile lanțurilor moleculare HA, DA și OA sunt de 1,56, 2,51 și, respectiv, 3,65 nm (McNulty et al., 2011, 2014). În general, distanța dintre straturi a compușilor de intercalare Kaol/alchilamină a crescut odată cu lungimea lanțului alchilic al alchilaminelor, dar molecula de alchilamină nu este o structură cu un singur strat sau bistrat care este perpendiculară pe suprafața Kaol.
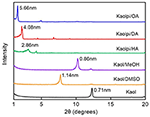
Figura 1. Diagramele XRD ale Kaol, Kaol/DMSO, Kaol/MeOH, Kaolpi/HA, Kaolpi/DA și Kaolpi/OA.
Spectre FTIR
Spectroscopia FTIR a fost utilizată pe scară largă în caracterizarea compușilor de intercalare (Ledoux și White, 1964; Frost et al., 2000c; Cheng et al., 2012). Spectrele FTIR ale compușilor de intercalare Kaol original, Kaolpi/HA, Kaolpi/DA și Kaolpi/OA sunt prezentate în figura 2. Benzile caracteristice de la 432, 470 și 541 cm-1 (Figura 2B) aparțin modului de deformare a Si-O, Si-O-Si și Al-O-Si. Celelalte benzi de la 1.009, 1.031 și 1.114 cm-1 (Figura 2C) sunt atribuite vibrațiilor de întindere ale Si-O-Si în stratul de Kaol. Comparând spectrele Kaol și ale compușilor săi de intercalare, poziția benzilor nu are nicio variație aparentă, ceea ce indică faptul că aceste benzi de vibrații de întindere nu sunt afectate de moleculele intercalate.
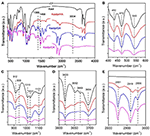
Figura 2. Spectrele în infraroșu ale Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Benzile de la 912 și 938 cm-1 (figura 2C) aparțin deformării OH a grupărilor hidroxilice interne și a grupărilor hidroxilice de pe suprafața internă. Există patru benzi evidente de întindere a hidroxilului la 3,694, 3,669, 3,652 și 3,620 cm-1 (Figura 2D) în spectrul originalului Kaol, benzile de la 3,694, 3,669 și 3,652 cm-1 sunt cauzate de grupurile hidroxilice de pe suprafața interioară, în timp ce cea de la 3,620 cm-1 rezultă din grupurile hidroxilice interioare (Farmer, 1964; Ledoux și White, 1964; Giese și Datta, 1973). După intercalarea moleculelor de alchilamină, unele benzi au fost slăbite din cauza modificării interacțiunilor cu atomii vecini. Deplasarea la 3,697 cm-1 și scăderea intensității benzii de la 3,694 cm-1 indică faptul că numeroasele grupe hidroxil din Kaol au participat și au format legături de hidrogen cu grupele amină din moleculele de alchilamină (Caglar, 2012; Caglar et al., 2013; Zhang et al., 2015).
Prezența moleculelor de alchilamină intercalate a fost detectată pe spectrul FTIR prin noile vârfuri, care sunt prezentate în figurile 2A,E. Pentru compușii de intercalare, unele vârfuri caracteristice evidente, cum ar fi banda de la 1,388 și 1,468 cm-1, aparțin modului de curbură C-H al -CH3 și, respectiv, -CH2. A fost observată o nouă bandă de vibrație la 3.334 cm-1 care se datorează modului de întindere a vibrației de întindere N-H (Griffiths și De Haseth, 2007; Zhang și colab., 2018). A fost observată o nouă bandă de vibrație la 2.956 cm-1 care, de obicei, este atribuită benzii de întindere asimetrică C-H a grupărilor metil terminale (Cheng et al., 2016). Cele două benzi de vibrație de la 2,919 și 2,851 cm-1 sunt de obicei atribuite vibrațiilor de întindere simetrice și asimetrice ale -(CH2)n- (Venkataraman și Vasudevan, 2001). Intensitatea benzilor crește treptat, ceea ce înseamnă că mai mulți atomi de carbon de alchilamină au fost introduși în straturile intermediare Kaol. În plus, volatilitatea alchilaminelor va scădea odată cu creșterea lanțului de carbon, astfel încât stabilitatea compușilor de intercalare Kaol corespunzători va crește treptat cu o masă moleculară mai mare de alchilamină (Wang et al., 2010).
Modelul structural al compușilor de intercalare Kaol/alchilamină
Dispoziția moleculelor intercalate reprezintă baza pentru analiza experimentală a structurii compușilor de intercalare Kaol/alchilamină. Conform lui Lagaly (1981), modelele structurale ale compușilor de intercalare a sărurilor de amoniu cuaternar de montmorillonit pot fi împărțite în trei categorii: (a) monostraturi: ioni de alchilamină cu lanț scurt; (b) bistraturi: ioni de amoniu cuaternar cu lanț lung; (c) trei straturi: lanțuri alchilice încolăcite în minerale argiloase foarte încărcate. Beneke și Lagaly (1982) au propus în continuare diferite structuri ale moleculelor de alchilamină intercalate pe baza XRD, care sunt rezumate după cum urmează: (a) lanțurile alchilice din spațiul dintre straturi sunt înclinate față de planul cristalin (001); (b) lanțurile alchilice sunt dispuse în bicapace. Brindley și Moll (1965) au descris faptul că moleculele intercalate sunt înclinate față de foile de silicat într-un singur strat, în timp ce unghiul este de aproximativ 65° față de planul cristalin (001). Dacă moleculele care interacționează sunt atașate în mod uniform la toate suprafețele de silicat prin grupările hidroxil active, se sugerează o organizare „cap la cap” în perechi cu o anumită deplasare longitudinală. Unghiul de înclinare este în concordanță cu posibila manieră de împachetare strânsă între suprafețele de oxigen ale silicatului și grupările hidroxil terminale și cu gradul de împachetare strânsă a moleculelor de lanț între ele.
Moleculele de alchil sunt greu de intercalat direct straturile originale de Kaol, deoarece îi lipsesc ionii schimbabili în spațiul interstrat al Kaol. Precursorii valabili sunt esențiali atunci când moleculele de alchilamină se inserează în stratul intermediar al Kaol. S-a raportat că lanțul de clorură de clorură de alchil trimetilamoniu formează un bistrat înclinat în stratul intermediar al Kaol, iar unghiul de înclinare este de ~36° după calcul (Kuroda et al., 2011). Yuan et al. (2013) au evidențiat faptul că aranjamentul structural al moleculelor de sare de amoniu cuaternar în stratul intermediar al bistratului înclinat de Kaol, iar unghiul de înclinare este de ~38,4°. Gardolinski și Lagaly (2005) au propus că lanțurile alchilice din straturile intermediare sunt complet întinse și orientate perpendicular pe suprafața Kaol de către bilayer. Prin urmare, din analiza lungimii lanțului de molecule HA, DA și OA, se poate trage concluzia că spațierea bazală după intercalare nu este suficientă pentru a permite lanțului alchilic să pătrundă în mod vertical și bistratificat. Se poate observa, analizând în continuare rezultatele XRD, că lanțurile alchilice ale HA, DA și OA sunt înclinate spre suprafața Kaol în bistrat, iar unghiul de înclinare a lanțurilor alchilice este de aproximativ 39,9, 39,9, respectiv 41,1°. În plus, datorită legăturii hidroxilice dintre hidroxilul de pe suprafața interioară din Kaol și grupările amină din moleculele de alchilamină, cel mai posibil model structural pentru compușii de intercalare Kaol/alchilamină este prezentat în figura 3.
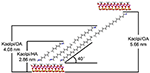
Figura 3. Modelul structural cel mai posibil pentru compușii de intercalare caolinit/alchilamină.
Analiză termică
Rezultatele analizei TG-DSC a Kaol și a compușilor săi de intercalare sunt prezentate în figura 4. Principala pierdere de masă a Kaol este cea cuprinsă între 400 și 600°C, rata maximă de pierdere la 525°C fiind atribuită pierderii de apă din cauza dehidroxilării rețelei cristaline, ceea ce duce la formarea meta-kaolinitului (Toussaint et al., 1963; Criado et al., 1984; Sperinck et al., 2011). Această pierdere corespunde la aproximativ 12,7% din masa totală, ceea ce este extrem de aproape de referința teoretică (13,9%). Prin compararea curbelor TG-DSC ale Kaol original, se observă două etape principale de pierdere de masă în cazul compușilor de intercalare Kaolpi/HA, Kaolpi/DA și Kaolpi/OA. Prima a avut loc între 150 și 350°C, care se datorează descompunerii moleculelor de alchilamină intercalate (Yuan et al., 2013). Cea de-a doua, care a avut loc la aproximativ 500°C, se datorează dehidroxilării Kaolului dezintercalat. În cazul Kaolpi/OA, o parte din OA au fost intercalate în spațiul interstratului de silicat pentru a forma o intercalare stabilă, care poate fi dovedită prin modelul XRD. Unele molecule sunt încurcate unele în altele din cauza lanțului lung sau a unei cleme în nanoscopuri care nu poate fi îndepărtată complet (Li et al., 2015; Liu et al., 2016). La 220°C, pierderea distinctă de masă se datorează descompunerii OA acoperit sau nelegat, în timp ce pierderea de masă la 330°C este atribuită descompunerii OA intercalat. Vârful exotermic de la 996°C este rezultatul recristalizării Kaol.
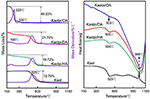
Figura 4. Curbele TG-DSC pentru Kaol, Kaolpi/HA, Kaolpi/DA, Kaolpi/OA.
Prin compararea curbelor TG-DSC ale compușilor de intercalare Kaol original și Kaol/alchilamină (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA), se poate observa:
Prin compararea curbelor TG-DSC ale compușilor de intercalare Kaol original și Kaol/alchilamină (Kaolpi/HA, Kaolpi/DA, Kaolpi/OA): (a) are diferite etape de pierdere de masă, precum și o diferență semnificativă în ceea ce privește pierderile de masă între Kaolpi/OA și ceilalți doi compuși de intercalare (Kaolpi/HA, Kaolpi/DA). Pierderile de masă pentru descompunerea Kaolpi/HA și Kaolpi/DA au fost de aproximativ 20%, dar valoarea celor două pierderi de masă pentru Kaolpi/OA este de aproximativ 50%. Acest lucru s-ar putea datora faptului că o cantitate mai mare de OA a fost intercalată în spațiul dintre straturile de silicat decât cea de HA și DA (Wang et al., 2017). (b) Temperatura de deshidroxilare a compușilor de intercalare a fost mai mică decât cea a Kaol original cu aproximativ 20°C. Acest lucru se datorează faptului că moleculele de intercalare au extins spațiul dintre straturi, au slăbit legăturile de hidrogen dintre straturile Kaol, aducând o dehidroxilare mai ușoară de pe suprafața Kaol. Prin urmare, cristalinitatea Kaol-ului a scăzut brusc după intercalare, ceea ce poate fi confirmat prin XRD și IR (sub 800 cm-1). Acest rezultat este în concordanță cu concluzia unor alte rapoarte conform cărora temperatura de dehidroxilare a fost determinată de cristalinitatea Kaol-ului (Yeskis et al., 1985; Gabor et al., 1995; Sahnoune et al., 2012).
Cinetica reacției de descompunere
Cinetica de degradare a compusului de intercalare Kaol/alchilamină a fost investigată prin tehnici de termogravimetrie. Parametrii cinetici (energia de activare E și factorul preexponențial A) ai procesului de degradare au fost calculați pe baza metodelor KAS și Ozawa (Kissinger, 1957; Škvára și Šesták, 1975). Mecanismul de degradare termică a compusului de intercalare Kaol/alchilamină a fost studiat cu ajutorul metodei integrale Satava (Xie și colab., 2001; Gao și colab., 2005; Zhang și colab, 2015).
Conform teoriei reacției, formula cinetică de descompunere non-izotermică este de obicei exprimată după cum urmează:
unde α este măsura ratei de conversie a B(s) la timpul t, f (α) este funcția mecanismului de reacție și k este constanta vitezei de reacție. k se supune următoarei ecuații:
Dacă temperatura probei este controlată la o rată de încălzire constantă (β = dT/dt), viteza de reacție poate fi definită după cum urmează:
După separarea variabilei, rearanjarea cu funcții integrale sau diferențiale a Ecuației (4), Ecuația KAS (5) și Ecuația Ozawa (6) pot fi calculate după cum urmează:
Unde G(α) reprezintă funcția integrală de conversie. Din cauza aproximației integrale, s-au folosit metode iterative pentru a calcula E pentru a evita anumite abateri. Funcțiile metodelor iterative sunt următoarele:
Stabilit x = E/RT, definiția lui h(x) și H(x) sunt:
Iterarea se face în următoarele trei etape:
(a) Se stabilește h(x) = 1 sau H(x) = 1, se calculează E0 prin metoda celor mai mici pătrate în funcție de panta relației liniare lnβ/T2 și lnβ la 1/T.
(c) Înlocuiți E0 cu E1, repetați pasul (b) până când Ei-Ei-1 < 0. 1 kJ mol-1. Ei este valoarea exactă a energiei de activare a reacției de descompunere.
Valorile E ale compușilor de intercalare Kaol/alchilamină au fost calculate prin metodele KAS, Ozawa și iterativă (tabelul 2). Rezultatele calculate obținute prin metoda KAS au fost mai apropiate de rezultatele obținute prin metodele iterative, cu toate acestea, rezultatele obținute prin metoda iterativă Ozawa au prezentat o abatere mai mare față de celelalte. Prin urmare, media E din metodele iterative poate fi considerată ca fiind energia de activare a reacției de descompunere, deoarece acestea reprezintă o îmbunătățire față de metodele KAS și Ozawa. E-urile medii ale Kaolpi/HA, Kaolpi/DA și Kaolpi/OA sunt de 104,44, 130,80 și 154,59 kJ mol-1 . Se poate observa că E-ul mediu al compușilor Kaol/alchilamină are o corelație pozitivă cu lungimea lanțului alchil. Unul dintre motive este că volatilitatea slăbește pe măsură ce lanțul alchilic crește. Un alt motiv este că Kaolpi/OA posedă cea mai bine ordonată structură de intercalare, care este cel mai dificil de dezintercalat. Iar aceste rezultate pot fi confirmate de modelele XRD.
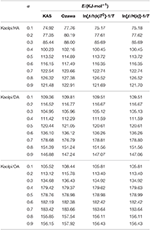
Tabel 2. E a compușilor de intercalare Kaol/alchilamină cu diferite α calculate prin metodele KAS, Ozawa și iterație.
Funcțiile și A ale mecanismului de reacție de descompunere au fost calculate prin metodele Satava, care au fost descrise după cum urmează:
Substituie α în fiecare funcție de mecanism G(α) pentru a obține valoarea lui lg, ajustarea liniară lg și 1/T care corespunde vitezei de încălzire, funcția care are cea mai mare potrivire poate fi determinată ca fiind cea mai probabilă funcție de mecanism. Iar valorile lui E și A pot fi obținute prin panta și interceptarea unei curbe de potrivire liniară.
Cum se arată în tabelul 3, cinci funcții de mecanism cu o bonitate de potrivire de peste 90% sunt alese pe baza formulei integrale Satava. Prin compararea celor cinci funcții, funcția de mecanism nr. 9 G(α) = 2 cu o bonitate de potrivire de aproximativ 97% poate fi considerată ca fiind cea mai probabilă funcție de mecanism, iar curbele de ajustare liniară a funcției nr. 9 au fost prezentate în figura 5. E și A sunt, de asemenea, în intervalul normal al cineticii de descompunere. Funcțiile mecanismului de descompunere pentru cei trei compuși de intercalare Kaol/alchilamină sunt prezentate în tabelul 4.

Tabel 3. Funcții de mecanism cinetic selectate, judecate prin metoda integrală Satava.

Figura 5. Curbele de ajustare liniară a funcției nr. 9 judecate prin metoda integrală Satava.

Tabel 4. Funcțiile mecanismului cinetic al compușilor de intercalare Kaol/alchilamină.
Concluzii
Modelele posibile de structură și cinetica de descompunere pentru compușii de intercalare Kaol/alchilamină au fost studiate folosind XRD, FT-IR și TG-DSC. Intercalarea compusului Kaol/MeOH cu HA, DA și OA extinde distanța dintre straturi a Kaol de-a lungul axei c, rezultând reflecția dominantă care apare la 2,86, 4,08 și, respectiv, 5,66 nm. Mai mult decât atât, distanța bazală după intercalare nu este suficientă pentru a permite intrarea lanțului alchilic în mod vertical mono și bistratificat. S-a concluzionat că lanțurile alchilice ale HA, DA și OA sunt înclinate față de suprafața Kaol în bistrat, iar unghiul de înclinare al lanțurilor alchilice este de ~40°.
Pe baza metodelor KAS, Ozawa și iterativă, au fost calculate rezultatele energiei de activare E a compușilor de intercalare Kaol/alchilamină. Energia medie de activare E a Kaolpi/HA, Kaolpi/DA și Kaolpi/OA este de 104,44, 130,80 și 154,59 kJ mol-1. Energia medie de activare E dintre compușii Kaol/alchilamină au o corelație pozitivă cu lungimea lanțului alchil. Funcția optimizată a mecanismului optimizat al procesului de descompunere Kaol/alchilamină a fost determinată ca fiind o difuzie 3D cu funcția integrală G(α) = 2. Această cercetare este avantajoasă pentru a înțelege mai bine mecanismul de descompunere a nanocompozitelor argilă/organice, în plus față de a oferi o sursă de inspirație pentru a sintetiza noi materiale pe bază de argilă.
Contribuții ale autorilor
HC și QfL au conceput experimentul și au revizuit lucrarea. YZ, QhL și PX au făcut experimentele și au scris lucrarea. YZ și QhL au contribuit în mod egal la această lucrare.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Dr. Luyi Sun (Departamentul de Inginerie Chimică și Biomoleculară și Programul de Polimeri, Institutul de Știința Materialelor, Universitatea din Connecticut) este recunoscut pentru revizuirea lucrării. Autorii recunosc cu recunoștință sprijinul financiar oferit de Fundația Națională de Științe Naturale a Chinei (41602171), Fundația de Științe Naturale din Beijing (8164062) și proiectul Yue Qi Young Scholar Project, Universitatea Chineză de Tehnologie Minieră &, Beijing.
Giese, R., și Datta, P. (1973). Orientarea hidroxilului în caolinit, dickit și nacrit. Am. Mineral. 58, 471-479.
Google Scholar
Griffiths, P. R., și De Haseth, J. A. (2007). Spectrometria în infraroșu cu transformată Fourier. New York, NY: John Wiley & Sons.
Google Scholar
Yeskis, D., Van Groos, A. K., și Guggenheim, S. (1985). Dehidroxilarea caolinitului. Am. Mineral. 70, 1-2.
Google Scholar
.
Lasă un răspuns