Forțe de dipol – dipol
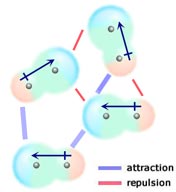
Dacă două molecule neutre, fiecare având un moment de dipol permanent, se întâlnesc astfel încât capetele lor cu sarcini opuse să se alinieze, ele vor fi atrase una de cealaltă. Într-un lichid sau solid, aceste alinieri sunt favorizate față de cele în care capetele cu sarcini similare ale moleculelor sunt apropiate și, prin urmare, se resping reciproc.
Un motiv pentru care CH3F are un punct de fierbere mai ridicat (-84 °C) decât CF4 (-128 °C) este faptul că CF3H are un moment de dipol permanent, în timp ce CF4 nu are. Pentru a înțelege pe deplin acest lucru trebuie să știți că CF4 are o formă tetraedrică, iar CH3F este aproximativ tetraedrică (nu există o mare diferență între formele acestor molecule). Legăturile carbon – fluor din ambele molecule sunt polare (fluorul este mult mai electronegativ decât carbonul), însă prezența a patru legături C-F în molecula tetraedrică CF4 face ca molecula să fie în general nepolară. Momentul de dipol al legăturii unice C-F din CH3F nu este anulat de dipolii legăturii C-H (care sunt foarte mici), astfel încât CH3F are un moment de dipol permanent.
Un tip de forță intermoleculară care poate apărea în circumstanțe particulare și care este de obicei clasificată ca o interacțiune dipol-dipol, deși are un anumit caracter de legătură covalentă, este legătura de hidrogen.
Lasă un răspuns