Ce au în comun minipreparatele de ADN și experimentele de imunoprecipitare a proteinelor? Ele încep diferit, dar se termină cu aceeași etapă critică – eluția. Dar ce este exact eluția și care este rostul ei?
Terminologie
În primul rând, să începem cu o terminologie de bază:
Eluție – extragerea unui material din altul prin spălare cu un solvent.
Absorbantul – o fază solidă, care poate fi un gel de silice în cazul coloanelor mini-prep, dar de obicei perle care pot fi legate covalent de anticorpi sau de alte molecule de ligand. „Faza solidă” nu înseamnă neapărat o coloană staționară; poate fi vorba de bile într-un eppendorf care sunt ușor de spălat.
Afinitatea – o măsură a capacității absorbantului de a lega molecula aleasă (ceea ce încercați să eluați). Cu cât este mai mare afinitatea fazei solide față de biomolecula aleasă (BOC), cu atât molecula se leagă mai strâns de ea. Cu toate acestea, nu doriți ca legarea să fie ireversibilă; acest lucru va face ca eluția să fie imposibilă.
Eluent – un solvent care îndepărtează BOC de pe absorbant.
Eluat – solventul care conține BOC îndepărtat de pe adsorbant.
Pregătirea materialului
Înainte de eluție, trebuie să absorbiți molecula aleasă, scăpând în același timp de contaminare. Aceasta este o etapă esențială, deoarece înțelepciunea convențională ne amintește „garbage in, garbage out”. Este posibil să aveți reactivi excelenți pentru eluție, dar dacă proba dvs. conține prea mult personal nelegat (termenul științific este „gunk”), acesta va bloca materialul de adsorbție. Saturarea fazei solide va împiedica BOC-ul dumneavoastră să absoarbă și apoi va contamina eluatul. Etapele eficiente de liză și curățare sunt esențiale pentru succesul experimentului dvs. de eluție.
Este important să determinați volumul materialului dvs. de preabsorbție. Volumul de lizat care trece prin mediul de absorbție nu trebuie să depășească 3 – 5 volume ale coloanei. Volumul mare de lizat care trece prin materialul de absorbție mărește timpul experimentului, precum și probabilitatea de absorbție a gunoaielor. În multe cazuri, merită să se reducă volumul inițial de lizat prin filtrare sau fracționare. Astfel, volumul de lizat determină dimensiunea coloanei.
Elegerea materialului de adsorbție depinde de compoziția chimică a moleculei care vă interesează. Absorbția biomoleculelor implică, de obicei, o interacțiune mai mult sau mai puțin specifică între substrat și moleculă. De exemplu, ADN-ul este absorbit pe mini-coloane datorită interacțiunii ionice dintre grupările fosfat de ADN încărcate negativ și particulele de silice încărcate pozitiv.
Proteinele sunt de obicei adsorbite pe sefaroză sau pe bile magnetice acoperite cu IgG.
După o aplicare inițială de lizat, în niciun moment coloana dvs. nu se poate usca. Acest lucru vă va „coace” molecula pe absorbant și va întrerupe integritatea coloanei. Dacă nu aveți timp să continuați experimentul, completați coloana cu un tampon compatibil și opriți curgerea.
Spălare
Scopul spălării fazei solide este de a îndepărta un material nelegat, lăsând în același timp molecula de interes pe coloană. Separarea selectivă este adesea obținută prin utilizarea unui tampon cu forță ionică scăzută (de exemplu, o concentrație scăzută de sare). Volumul tamponului de spălare ar trebui să fie apropiat de cantitatea de material inițial și să fie de cel puțin 3-5 volume ale coloanei.
Cu toate acestea, după ce mai multe volume de tampon de spălare au trecut prin coloană, contaminările vor fi spălate și orice spălare suplimentară nu va îmbunătăți calitatea preparatului dumneavoastră. Mai mult decât atât, veți începe să pierdeți materialul țintă.
Eluție
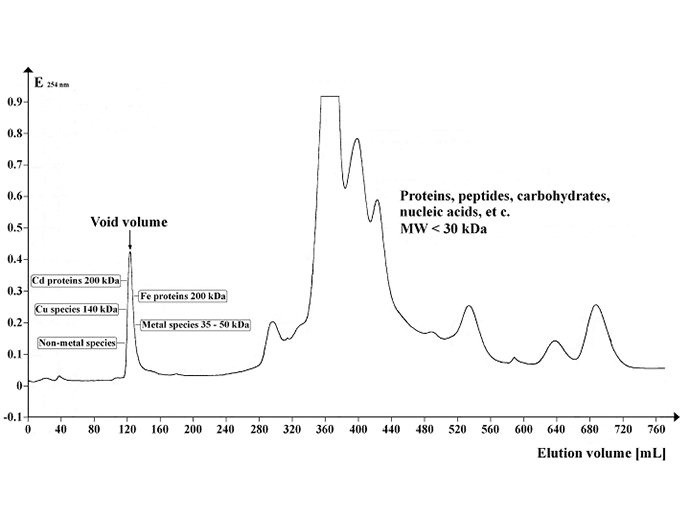
Imagine: Cromatogramă care arată profilul de absorbție UV al supernatantului de Arabidopsis separat pe Sephadex G-50 Superfine. Volumul gelului: 500 ml; lungimea coloanei: 700 mm; diametrul coloanei: 30 mm; debitul de eluent: 12 ml / oră; volumul fracției: 8,0 ml; numărul de fracții: 95; volumul probei: 5 mL; temperatura de separare: 4 °C; tampon de eluție: 20 mM Tris-HCl 20 mM, 1 mM NaN3; pH 8,0. Credit imagine: https://commons.wikimedia.org/wiki/File:Chrom_SephG-50.tif
Eluția în sine funcționează pentru că întrerupeți legăturile dintre coloană și substrat (de exemplu, prin utilizarea unei săruri mari sau a unei temperaturi ridicate a eluentului). Eluția se face de obicei într-un volum mic de tampon compatibil cu stocarea probei și cu aplicațiile ulterioare.
Eluția ADN-ului din coloana mini-prep este cel mai simplu caz: un volum de tampon îndepărtează aproape tot ADN-ul. Concentrația de ADN din eluat este invers proporțională cu tamponul de eluție utilizat: cu cât se utilizează mai mult tampon, cu atât mai mică este concentrația finală de ADN. Cu toate acestea, chiar și în acest caz, majoritatea producătorilor recomandă utilizarea unui volum suplimentar pentru a elimina tot ADN-ul.
Pentru coloane, viteza de eluție este critică. O viteză prea mică va crește șansele de degradare a moleculei; prea rapidă și nu va exista o rezoluție a fracțiilor.
Pentru coloanele de volum mare, trebuie să colectați fracții de eluat deoarece molecula dvs. va fi distribuită între ele. Prima fracție va conține un amestec de tampon de spălare și de eluție și o eventuală contaminare care nu a fost eliminată de tamponul de spălare.
Puteți monitoriza DO pentru tipul dumneavoastră de moleculă (260nm/280nm pentru ADN) și puteți face un blot pentru concentrația moleculei dumneavoastră specifice în fiecare fracție. În cel mai simplu caz, distribuția moleculei dvs. va urma o curbă în clopot simplă, dar poate avea unul sau mai multe vârfuri ascuțite.
În concluzie, cunoașterea parametrilor de bază ai experimentului dvs. (absorbant, dimensiunea coloanei, tamponul de spălare, tamponul de eluție, debitul, numărul de fracții) și a principiilor generale de eluție vă vor permite să vă configurați cu succes eluția.
Pentru mai multe detalii, găsiți un articol în care ceilalți oameni de știință au făcut ceva similar – în mod ideal aceeași moleculă, dar o moleculă asemănătoare va fi suficientă – și adaptați-o la condițiile dumneavoastră.
.
Lasă un răspuns