- Ce sunt corticoizii?
- Corticoizi și cortizol
- Tipuri
- Boli care pot fi tratate cu corticosteroizi
- Absorbție sistemică
- Efecte secundare
- Efecte secundare cutanate
- Efecte secundare oculare
- Efecte metabolice
- Efecte cardiovasculare
- Efecte musculo-scheletice
- Efecte secundare la nivelul sistemului nervos central
- Efecte imunologice
- Alte efecte
- Îngrijirea și pericolele utilizării corticosteroizilor
- Referințe
Ce sunt corticoizii?
Glucocorticoizii, numiți și corticosteroizi sau corticosteroizi, sunt medicamente puternice derivate din hormonul cortizol, care este produs de glanda suprarenală.
Corticosteroizii sunt adesea utilizați ca parte a tratamentului bolilor de origine inflamatorie, alergică, imunitară și chiar împotriva unor tipuri de cancer.
Deși un medicament foarte eficient împotriva mai multor boli grave, corticosteroizii au un defect major: un profil foarte extins de efecte secundare, unele dintre ele grave, altele nedorite din punct de vedere estetic.
Când sunt folosiți îndelungat, corticosteroizii duc la creșterea în greutate, pot cauza vergeturi, provoacă acnee, slăbesc oasele, cresc riscul de infecții etc.
În acest articol ne vom ocupa de indicațiile și efectele secundare ale corticosteroizilor, cu accent pe prednison și prednisolon, cele mai utilizate medicamente din această clasă.
Dacă sunteți în căutarea unui prospect simplificat pentru prednison, accesați următorul articol: PREDNISONA – La ce servește, doze și îngrijire
Pentru informații despre utilizarea corticosteroizilor în COVID-19, accesați următoarele articole:
- DEXAMETHASONĂ – BULA PENTRU PACIENȚI.
- INFORMAȚII DESPRE COVID-19.
Corticoizi și cortizol
Glucocorticoizii sunt hormoni steroizi, neanabolici și non-sexuali, produși de cortexul glandei suprarenale. Hormonul produs în mod natural de organismul nostru este cortizolul.
Nivelurile normale de cortizol sunt esențiale pentru sănătatea noastră, deoarece acest hormon are o acțiune asupra metabolismului glucozei, a funcțiilor metabolice ale organismului, a vindecării, a sistemului imunitar, a funcției cardiace, a controlului creșterii și a multor alte acțiuni de bază ale organismului nostru.
Cortizolul este un hormon al stresului, deoarece producția sa crește de fiecare dată când organismul nostru este supus unui stres fizic, cum ar fi în caz de traume, infecții sau intervenții chirurgicale. Cortizolul crește disponibilitatea glucozei și a energiei, ridică tensiunea arterială, crește tonusul cardiac și pregătește organismul să sufere și să lupte împotriva insultelor.
Tipuri
Glucocorticoizii folosiți în practica medicală sunt versiuni sintetice, produse în laborator, ale hormonului natural cortizol.
Există mai multe formulări sintetice de corticosteroizi, cele mai frecvent utilizate sunt prednisonul, prednisolonul, hidrocortizonul, dexametazona, metilprednisolonul și beclometazona (pe cale inhalatorie).
Toți corticosteroizii sintetici sunt mai puternici decât cortizolul natural, cu excepția hidrocortizonului, care are o potență similară.
Potența fiecărui tip de corticoid în raport cu cortizolul:
- Hidrocortizon → putere similară cu cea a cortizolului.
- Deflazacort → de 3 ori mai puternic decât cortizolul.
- Prednisolon → de 4-5 ori mai puternic decât cortizolul.
- Prednison → de 4-5 ori mai puternic decât cortizolul.
- Triamcinolon → de 5 ori mai puternic decât cortizolul.
- Metilprednisolon → de 5-7,5 ori mai puternic decât cortizolul.
- Betametazonă → de 25-30 ori mai puternic decât cortizolul.
- Dexametazona → de 25-30 de ori mai puternică decât cortizolul.
- Beclometazona (inhalată) → 8 pufuri de 4 ori pe zi echivalează cu 14 mg de prednison orală zilnică.
60 mg de prednison au același efect ca 2 mg de dexametazonă sau 300 mg de cortizol natural. Datorită acestei puteri mai mari a corticosteroizilor de sinteză, putem administra pacienților doze cu mult peste nivelul fiziologic de cortizol, ceea ce este esențial pentru tratamentul unor boli.
Boli care pot fi tratate cu corticosteroizi
Prednisonul și corticosteroizii în general sunt medicamente care pot modula procesele inflamatorii și imunologice din organismul nostru, ceea ce le face extrem de utile într-o multitudine de boli. Orice boală de origine alergică, inflamatorie sau autoimună poate fi tratată cu oricare dintre acești corticoizi (citește și: CE ESTE O BOALĂ AUTOIMUNĂ?).
Pentru a ne face o idee despre importanța corticoizilor în practica medicală, putem cita următoarele boli ca indicații pentru administrarea lor:
- Astm.
- Scleroză multiplă.
- BPOC.
- Alergii, în special anafilaxie.
- Hepatită autoimună.
- Herpes Zoster.
- Lupus.
- Poliartrită reumatoidă.
- Leucemie.
- Limfom.
- Purpură trombocitopenică idiopatică (PTI).
- Mielom multiplu.
- Edem cerebral.
- Paralizie facială Bell.
- Gută.
- Sarcoidoză.
- Rinită alergică.
- Vitiligo.
- Psoriazis.
- Granulomatoza lui Wegener.
- Boala inflamatorie intestinală.
- Miastenia Gravis.
- Vasculite.
- Boala Addison (insuficiență suprarenală).
- Glomerulonefrită.
- Boli de piele de origine inflamatorie sau autoimună.
- Sindromul Sjögren.
- Transplant de organe.
- Urticarie.
Dozele zilnice echivalente cu 5-10 mg de prednison sunt numite doze fiziologice deoarece sunt compatibile cu producția naturală zilnică de cortizol. La aceste doze, corticosteroizii de sinteză prezintă doar efect antiinflamator.
În situații normale, secreția de cortizol de către suprarenale prezintă un ciclu circadian, adică suferă modificări în funcție de perioada zilei. În primele ore ale dimineții, secreția sa este foarte mare, reducându-se la un maxim în jurul orei 23.00. Prin urmare, alegem să administrăm corticoizii dimineața pentru a încerca să simulăm secreția fiziologică cu care organismul este obișnuit, reducând astfel incidența efectelor secundare.
Pe măsură ce doza este crescută, prednisonul, sau orice alt glucocorticoid, începe să prezinte efecte imunosupresoare, ceea ce justifică utilizarea sa în bolile autoimune și în transplantul de organe.
În bolile autoimune și în glomerulonefrite putem folosi până la 80 mg de prednison pe zi. În cazurile severe, folosim o procedură numită terapie prin impulsuri, care constă în administrarea intravenoasă de până la 1000 mg de metilprednisolon timp de 3 zile consecutive. Această terapie pulsatorie poate fi utilizată în vasculite severe, în cazurile de respingere a organelor transplantate și în tratamentul bolilor autoimune severe și decompensate, așa cum apare în unele cazuri de Lupus, de exemplu.
Corticosteroizii pot fi administrați pe diferite căi. De exemplu, corticoizii sistemici sunt cei administrați pe cale orală sau intravenoasă. În astm, administrarea de corticosteroizi inhalatori este foarte frecventă. În cazul rinitei și sinuzitei, calea preferată este cea intranazală. În bolile de piele, corticoizii sunt topici, adică în creme sau unguente. Corticoizii pot fi disponibili sub formă de picături pentru ochi și soluții care pot fi administrate în urechi. În artrită, calea poate fi intraarticulară (infiltrație).
Absorbție sistemică
Marea majoritate a reacțiilor adverse apar la pacienții care iau în mod prelungit, doze mari de corticosteroizi pe cale orală sau intravenoasă. Acest lucru nu înseamnă, totuși, că celelalte forme de administrare a corticosteroizilor sunt lipsite de efecte adverse.
Corticosteroizii inhalați, utilizați pe scară largă în tratamentul astmului, pot avea o absorbție sistemică relevantă, deși aceasta este mult mai mică decât cea care apare în cazul corticosteroizilor administrați pe cale orală. Se știe că fluticasona inhalată, de exemplu, inhibă producția de cortizol de către glanda suprarenală și poate provoca efecte secundare sistemice atunci când este utilizată continuu timp de mai multe luni, în special la copii. Alte forme de corticosteroizi inhalatori par să aibă o absorbție sistemică mai mică.
Injecțiile intraarticulare de dexametazonă pot provoca sindromul Cushing (explic ce este această modificare mai târziu).
Chiar și corticosteroizii în unguent sau cremă pot fi absorbiți în organism suficient de mult pentru a provoca efecte secundare dacă sunt utilizați pentru o perioadă prelungită. Absorbția corticosteroizilor în piele variază în funcție de o serie de factori. De exemplu, zone precum pliurile pielii, scalpul și fruntea sunt mai susceptibile de a fi absorbite. La copii și în zonele cu inflamație sau descuamare a pielii, absorbția sistemică a corticosteroizilor este, de asemenea, mai mare.
În general, nu există nicio formă de corticosteroid care să fie lipsită de efecte secundare. Indiferent de cale, cu cât durata tratamentului și doza utilizată sunt mai lungi, cu atât riscurile de efecte adverse sunt mai mari.
Efecte secundare
În timp ce sunt medicamente extrem de utile într-o varietate de boli grave, corticosteroizii au, mai ales dacă sunt utilizați pe termen lung, o listă uriașă de efecte secundare nedorite, de la probleme cosmetice până la infecții grave datorate inhibării sistemului imunitar.
Efectele secundare sunt strâns legate de doză și de timpul de utilizare. Nu este probabil ca utilizarea sporadică și pe termen scurt să conducă la efectele adverse care vor fi descrise mai jos. Nu trebuie să vă faceți griji cu privire la prescrierea de corticoizi pentru doar o săptămână, chiar dacă sunt în doze mari. Utilizarea va fi indicată ori de câte ori medicul apreciază că boala care trebuie tratată este mai gravă decât potențialele efecte adverse.
După ce ați citit acest articol s-ar putea să aveți impresia că prednisonul și medicamentele similare sunt medicamente teribile. Este important de reținut că utilizarea prelungită, în doze mari, este de obicei indicată doar în cazul unor boli grave, ceea ce poate duce la deces sau la limitări severe.
Efecte secundare cutanate
Efectele estetice ale corticosteroizilor deranjează cel mai mult pacienții, în special femeile. Aproximativ jumătate dintre persoanele care utilizează cel puțin 20 mg pe zi de prednison sau o doză echivalentă de orice alt corticosteroid timp de trei sau mai multe luni vor prezenta efecte secundare estetice.
Cele mai frecvente dintre acestea includ echimoza și purpura asociate cu corticosteroizi. Aceste modificări sunt mici hemoragii care apar sub piele, de obicei în zonele expuse la soare, cum ar fi mâinile și antebrațele. Un alt efect advers frecvent este pielea mai subțire și mai fragilă.
Straturile de culoare purpurie localizate în regiunea abdominală, calviția, creșterea părului la femei și acneea apar, de asemenea, frecvent la utilizatorii cronici de corticosteroizi orali.
Riscul de apariție a cancerelor cutanate de tip non-melanom pare să fie mai mare la persoanele care iau corticosteroizi pentru o perioadă prelungită de timp.
Pacienții care iau corticosteroizi în creme și unguente pentru o perioadă lungă de timp pot prezenta, de asemenea, efecte nedorite asupra pielii, cum ar fi atrofie, vergeturi, teleangiectazii și pete purpurii. Un risc crescut de infecții fungice la nivelul pielii apare, de asemenea, în cazul unui tratament prelungit.
Un semn tipic al toxicității corticosteroizilor este dezvoltarea aspectului „cushingoid”, care se caracterizează printr-o față rotunjită (numită facies lunar), acumularea de grăsime în regiunea posterioară a gâtului și a spatelui (numită cocoașă sau giba de bivol) și distribuția neuniformă a grăsimii corporale, cu predominanță în regiunea abdominală și în trunchi.
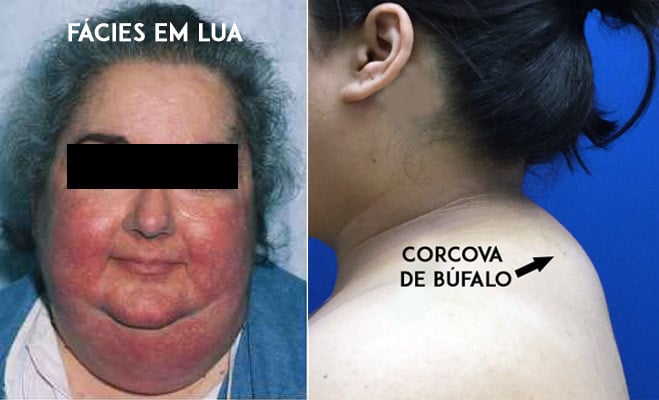
Acest set de reacții adverse, denumit sindromul Cushing, este unul dintre cele mai supărătoare, deoarece modifică foarte mult aspectul pacientului, în special la persoanele care înainte erau slabe.
Sindromul Cushing apare de obicei în primele două luni de tratament cu corticosteroizi în doze de peste 20 mg pe zi. Cu toate acestea, la unii pacienți, dozele de peste 10 mg pe zi sunt deja suficiente pentru a determina această modificare.
Efecte secundare oculare
Utilizarea continuă a corticosteroizilor sistemici, de obicei timp de peste 1 an cu doze mai mari decât echivalentul a 10 mg de prednison pe zi, poate duce la modificări oftalmologice, cum ar fi cataractă și glaucom. Atât corticosteroizii utilizați pe cale orală, nazală (spray nazal pentru astm sau bronșită) sau sub formă de picături pentru ochi pot provoca ambele boli.
Pacienții care iau corticosteroizi în mod cronic trebuie evaluați periodic de către un oftalmolog pentru a depista semnele timpurii de cataractă sau glaucom.
Efecte metabolice
După o doză de 5 mg pe zi există o tendință clară de creștere în greutate și de acumulare de grăsime în regiunea trunchiului și a abdomenului. Cu cât doza de corticoid este mai mare, cu atât creșterea în greutate este mai mare.
Pe lângă acumularea de grăsime, corticoterapia cronică duce, de asemenea, la alterări ale metabolismului glucozei și poate provoca chiar diabet zaharat. Riscul este mai mare la persoanele care au deja valori ușor alterate ale glucozei înainte de începerea corticoterapiei. Deși diabetul este reversibil în majoritatea cazurilor după întreruperea tratamentului, unii pacienți rămân diabetici toată viața.
Dozele zilnice de prednison de peste 10 mg timp de mai mult de 3 luni pot determina, de asemenea, modificări ale nivelului colesterolului, și anume creșteri ale colesterolului LDL (colesterol rău) și ale trigliceridelor și reducerea nivelului de colesterol HDL (colesterol bun).
Efecte cardiovasculare
Incidența diferitelor boli cardiovasculare crește de obicei odată cu utilizarea prelungită a corticosteroizilor. Putem cita apariția crescută a hipertensiunii arteriale, a infarctului miocardic, a insuficienței cardiace și a accidentului vascular cerebral.
Riscul de boli cardiovasculare depinde de doza și durata tratamentului. Pacienții care dezvoltă sindromul Cushing au, de obicei, cea mai mare rată de ateroscleroză și cel mai mare risc de probleme cardiace.
Dozele mici de corticosteroizi pentru o perioadă scurtă de timp nu par să crească riscul cardiovascular în nici un mod relevant.
Efecte musculo-scheletice
Utilizarea cronică a glucocorticoizilor este asociată cu mai multe modificări musculo-scheletice. Cea mai frecventă este osteoporoza. În acest caz, chiar și dozele mici, cum ar fi 2,5 mg sau 5 mg pe zi, dacă sunt utilizate în mod cronic, pot accelera pierderea de masă osoasă.
Corticoterapia prelungită este, de asemenea, responsabilă de o incidență crescută a necrozei osoase, a leziunilor musculare (miopatie), a fracturilor osoase și a tulburărilor de creștere atunci când este utilizată la copii.
Efecte secundare la nivelul sistemului nervos central
Utilizarea corticoizilor, la început, poate provoca o senzație de bunăstare și euforie. Cu toate acestea, pe termen lung se asociază cu o incidență mai mare a afecțiunilor psihiatrice, cum ar fi psihoza și depresia, precum și cu insomnia și alterări ale memoriei.
Efecte imunologice
Imunosupresia provocată de corticoterapie este un efect de dorit în cazul bolilor autoimune, dar poate fi și o mare problemă, deoarece facilitează apariția infecțiilor. Trebuie să se știe cum să se echilibreze bine riscurile cu beneficiile.
Riscul de infecție apare la cei care iau echivalentul a 10 mg pe zi sau mai mult de prednison timp de mai multe zile. Acest risc devine foarte mare cu doze mai mari de 40 mg pe zi sau atunci când se obține o doză cumulată de 700 mg de prednison pe întreaga durată a tratamentului.
Pe lângă faptul că facilitează infecția, corticosteroizii inhibă și apariția febrei, făcând dificilă recunoașterea unui proces infecțios în curs.
Pacienții supuși unor doze mari de corticosteroizi trebuie să evite vaccinurile compuse din virusuri vii, la riscul de a dezvolta infecții vaccinale. Se pot administra vaccinuri cu viruși uciși, însă corticoterapia poate împiedica și formarea de anticorpi, ceea ce face ca imunizarea să aibă o eficacitate redusă. Doze mai mari sunt adesea necesare pentru o imunizare eficientă.
Candidoza orală și candidoza vaginală sunt infecții foarte frecvente la pacienții cu utilizare cronică de glucocorticoizi.
Alte efecte
Lista efectelor secundare posibile ale corticosteroizilor este foarte extinsă. În plus față de cele deja menționate, alte efecte adverse relativ frecvente sunt retenția de lichide, modificări menstruale, gastrită, ulcer peptic, steatoză hepatică, pancreatită și infertilitate.
Îngrijirea și pericolele utilizării corticosteroizilor
Corticoterapia îndelungată necesită o anumită atenție, în special atunci când se întrerupe administrarea medicamentului.
Utilizarea pe termen lung a prednisonului sau a medicamentelor similare inhibă producția naturală de cortizol de către glanda suprarenală. Deoarece corticosteroizii de sinteză au un timp de înjumătățire de numai câteva ore, întreruperea bruscă face ca după 2 sau 3 zile nivelurile de cortizol să fie aproape de zero. Atunci când suprarenala este inhibată pentru o perioadă lungă de timp prin administrarea de corticosteroizi exogeni, este nevoie de timp până când aceasta revine la producerea naturală de cortizol.
În general, tratamentele care durează mai puțin de 3 săptămâni nu provoacă de obicei efecte secundare majore sau provoacă o inhibiție prelungită a suprarenalelor.
Pentru că cortizolul este un hormon esențial pentru viață, pacientul care întrerupe brusc corticosteroizii de sinteză intră într-o stare numită insuficiență suprarenală și poate evolua spre șoc circulator, comă și deces dacă nu este îngrijit rapid.
De aceea, retragerea corticosteroizilor după o utilizare prelungită trebuie să se facă întotdeauna lent și treptat. Tratamentul nu trebuie niciodată întrerupt fără cunoștințe medicale.
Referințe
- Terapia corticosteroidă sistemică – efecte secundare și managementul lor –
British Journal of Ophthalmology. - Recenzie: Efecte secundare pe termen lung ale glucocorticoizilor – Journal Expert Opinion on Drug Safety.
- Glucocorticoizi – Huntington’s Outreach Project for Education, la Stanford.
- Prevenirea și tratamentul efectelor secundare ale glucocorticoizilor sistemici – Revista Internațională de Dermatologie.
- Utilizarea farmacologică a glucocorticoizilor – UpToDate.
- Efecte secundare majore ale glucocorticoizilor sistemici – UpToDate.
- Efecte adverse ale corticosteroizilor – StatPearls.
Lasă un răspuns