- Ce este fierul
- Unde se găsește fierul
- Istorie
- Identificare
- Clasificare, Proprietăți și caracteristici ale fierului
- Proprietăți generale
- Proprietăți fizice
- Proprietăți chimice
- Datele atomice ale fierului (Elementul 26)
- Care sunt utilizările comune ale fierului
- Elementul are efecte toxice
- Fapte interesante
- Prețul fierului metalic
Ce este fierul
Fierul (pronunțat EYE-ren) este un metal dur cu o valoare comercială ridicată, aparținând familiei metalelor de tranziție. Reprezentat prin simbolul chimic Fe, este reactiv din punct de vedere chimic, având tendința de a se coroda ușor în aer, formând un strat roșiatic numit rugină atunci când este expus la aer umed .

Simbolul fierului
Unde se găsește fierul
Este al patrulea cel mai abundent metal din scoarța terestră, asociat în mod obișnuit cu alte minereuri minerale precum hematita, taconita și magnetita care se găsesc în rezervele miniere din Ucraina, Brazilia, Rusia, Australia și China. Producția sa comercială se realizează într-un furnal, prin încălzirea minereurilor cu cocs și calcar.
Istorie
Originea numelui său: Numele elementului provine de la un cuvânt anglo-saxon „fier”.
Cine l-a descoperit: Necunoscut
Când, unde și cum a fost descoperit
În jurul anului 3500 î.Hr. se crede că egiptenii foloseau obiecte din fier. Se știe că hitiții din Asia Mică au topit metalul din minereurile sale în cursul anului 1500 î.Hr. În 1722, René Antoine Ferchault de Réaumur, un entomolog francez, a publicat o carte, descriind semnificația diferitelor aliaje de fier .

Fier metal
Identificare |
|||
| Numărul atomic | 26 | ||
| Numărul CAS | 7439-89-6 | ||
| Poziția în tabelul periodic | Grupa | Perioada | Bloc |
| 8 | 4 | d | |
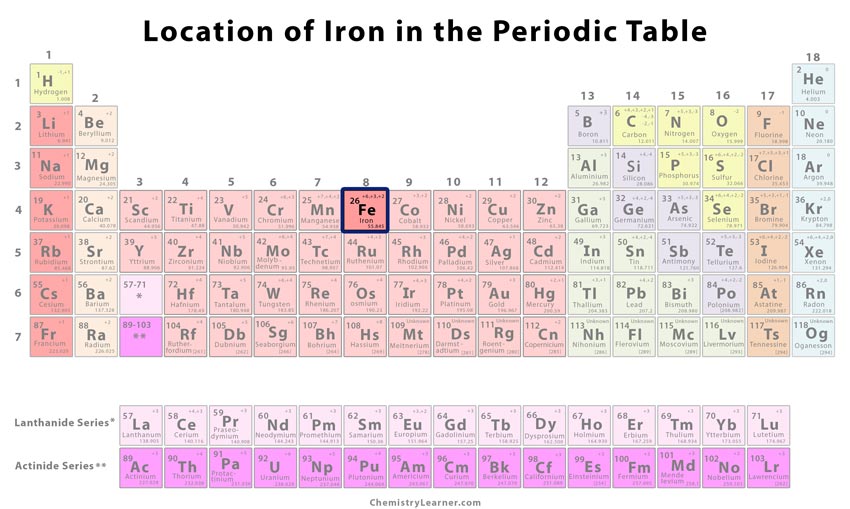
Unde se află fierul în tabelul periodic
Clasificare, Proprietăți și caracteristici ale fierului
Proprietăți generale |
||
| Masa atomică relativă | 55.845 | |
| Masa atomică/greutate | 55,845 unități de masă atomică | |
| Masa molară/greutate moleculară | 55.845 g/mole | |
| Numărul de masă | 56 | |
Proprietăți fizice |
||
| Culoare/aspect fizic | Gri argintiu | |
| Punctul de topire/punctul de congelare | 1538°C (2800°F) | |
| Punctul de fierbere | 2861°C (5182°F) | |
| Densitate | 7.87 g/cm3 | |
| Stare standard/naturală la temperatura camerei (solid/lichid/gaz) | Solid | |
| Maleabilitate | Da | |
| Ductibilitate | Da | |
| Duritate | 4-5 Mohs | |
| Capacitate termică specifică | 0.444 J g-1 oC | |
| Conductivitatea termică | 80.4 Wm-1K-1 | |
Proprietăți chimice |
||
| Inflamabilitate | Nu este inflamabil | |
| State de oxidare (numere) | 6, 3, 2, 0,-2 | |
Datele atomice ale fierului (Elementul 26)
| Configurația electronilor (configurația gazelor nobile) | 3d64s2 | ||||||
| Structura atomică | |||||||
| – Numărul de electroni | 26 | ||||||
| – Numărul de neutroni | 30 | ||||||
| – Număr de protoni | 26 | ||||||
| Radioul atomului | |||||||
| – Raza atomică | 2.04 Å | ||||||
| – Raza covalentă | 1.24 Å | ||||||
| Energia de ionizare
(kJmol-)1) |
1-lea | 2-lea | 3-lea | 4-lea | 5-lea | 6-lea | 7-lea |
| 762.466 | 1561.876 | 2957.469 | 5287.4 | 7236 | 9561.7 | 12058.74 | |
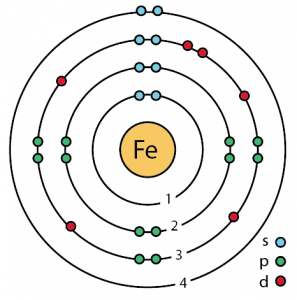
Structura atomică a fierului (Modelul Bohr)
Care sunt utilizările comune ale fierului
- Fierul este utilizat la fabricarea diferitelor tipuri de oțel prin alierea cu alte elemente precum carbonul, nichel, crom și tungsten pentru fabricarea echipamentelor de tăiere, a lanțurilor de biciclete, a țevilor de pușcă, a turnurilor de transmisie, a grinzilor de pod și a betonului armat .
- Oțelul inoxidabil care conține un procent ridicat de fier împreună cu alte metale are o rezistență enormă și o funcție mai bună care este utilă în fabricarea instrumentelor chirurgicale, agrafe de hârtie, tacâmuri, rulmenți cu bile și bijuterii .
- O altă formă de Fe numită fier forjat obținut prin topire este folosit pentru a face unelte de tâmplărie, cârlige de ridicare, lanțuri, garduri și porți .
- Ferul de umplutură se aplică în experimentele științifice de electromagnetism pentru a evalua puterea magneților, precum și în metalurgia energetică, opere de artă, artificii și sablare .
- Fe acționează ca un catalizator eficient este unele procese chimice industriale, cum ar fi procesul Haber și Fischer-Tropsch .

Bara de fier
Elementul are efecte toxice
Ingestia accidentală de Fe a fost asociată cu vărsături, diaree și alte probleme gastrointestinale, un tip comun de otrăvire cu metale. Acumularea prelungită în organism ar putea duce la probleme respiratorii și tulburări cardiace . Inhalarea prafului de metal sau a fumului poate provoca o reacție pulmonară severă .
Fapte interesante
- Se crede că meteoriții au un conținut ridicat de fier .
- Fierul a fost folosit ca metal magnetic de către navigatorii antici sub formă de lodestones pentru fabricarea busolelor .
- În corpul uman mediu sunt prezente 4 grame de Fe, asociate cu hemoglobina care, la rândul ei, ajută la transportul oxigenului către plămâni .
-

Pudră de fier
Prețul fierului metalic
Costul fierului pur poate varia între 0,24 și 0,30 dolari pe livră.
- http://www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.thoughtco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.html
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wrought-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/1592301
Lasă un răspuns