Elementele din grupa 13 includ metalele de post-tranziție.
Expresia metale de post-tranziție se referă la acele elemente care sunt metale după metalele de tranziție. Ca și în cazul conceptului de metaloid, nu există un consens universal cu privire la ce anume este un metal post-tranziție. Din fericire, în practică este mai puțin important să se definească cu precizie ce este și ce nu este un metal post-tranziție decât să se înțeleagă motivul pentru care ar putea fi utilă clasificarea elementelor ca fiind un metal post-tranziție.
Caracteristicile principale ale metalelor de post-tranziție sunt că sunt relativ bogate în electroni și electronegative în comparație cu ceea ce se consideră în mod clasic a fi un metal. În linii mari, acest lucru se traduce prin puncte de topire relativ mai scăzute (deoarece tind să fie ocupate mai multe niveluri antilegare în structura benzii), o preferință crescută pentru covalență și o mai mare fragilitate decât alte metale (datorită legăturii direcționale rezultate). Bogăția lor electronică înseamnă că au tendința de a forma cationi moi.
Mai multe sisteme sunt folosite pentru a clasifica elementele ca aparținând metalelor de post-tranziție. Principalele includ:
- Metale care urmează blocul d. Prin această definiție sunt incluse numai metalele din grupele 13 și superioare și din rândurile 3 și superioare care formează cationi relativ moi și bogați în electroni și prezintă o covalență semnificativă în legăturile lor. Cu toate acestea, dacă această schemă este adoptată în mod prea rigid, Al este exclus, deoarece, din punct de vedere tehnic, nu urmează blocul d (și are un subshell (n-1)d neîmplinit), iar metaloizii sunt excluși, chiar dacă mulți dintre ei formează, de asemenea, cationi relativ moi și bogați în electroni cu subshell-uri (n-1)d pline. Un alt dezavantaj al acestui sistem este acela că încurcă chestiunea de a ști ce elemente ar trebui clasificate ca metale de post-tranziție cu chestiunea spinoasă de a ști ce elemente ar trebui clasificate ca metale vs. metaloizi.
- Metale și metaloizi din blocul p. Acest sistem are avantajul de a sublinia proprietățile interesante și unice ale metalelor și metaloizilor din blocul p, precum și continuitatea acestor proprietăți în cadrul blocului p. În consecință, acesta va fi utilizat în secțiunile care urmează. Cu toate acestea, are dezavantajul de a exclude metale precum Zn, Cd și Hg, care dau naștere la mulți compuși în care metalul are o configurație (n-1)d10.
- Metale care urmează elementele de tranziție în sensul formării de ioni cu un înveliș de valență (n-1)d complet, uneori împreună cu Al și metaloizii din blocul p. Această definiție adaugă Zn, Cd și Hg (și uneori Cu, Ag și Au), deoarece formează ioni cu o configurație electronică de valență (n-1)d 10, cum ar fi Zn2+, Cd2+ și Hg2+(și Cu+, Ag+ și Au+). Deoarece acest capitol ia în considerare doar elementele din blocul p pentru pentru scopurile acestui capitol, acest sistem este funcțional identic cu sistemul 2.
Indiferent de schema de clasificare pe care o folosim, este adesea mai util să ne gândim la clasificarea elementelor ca metale post-transit ca la o modalitate de a sublinia asemănările în proprietățile chimice ale unui set de elemente decât ca la o modalitate de a sublinia modul în care metalele post-transit diferă de alte metale. Metalele post-tranziționale nu sunt singurele care formează cationi moi sau compuși mai bine descriși ca fiind ținuți împreună prin legături covalente. După cum au arătat clar secțiunile anterioare, chiar și metalele alcaline formează anioni în circumstanțele potrivite și mulți compuși ai metalelor sunt mai bine descriși în termeni de covalență decât de interacțiuni ionice. Acest lucru era deja evident în chimia metalelor alcalino-pământoase Be și Mg, discutate în secțiunea anterioară. În capitolele următoare, legătura și reactivitatea în complexele de coordonare și compușii organometalici vor fi descrise în mare parte în termeni covalenți.
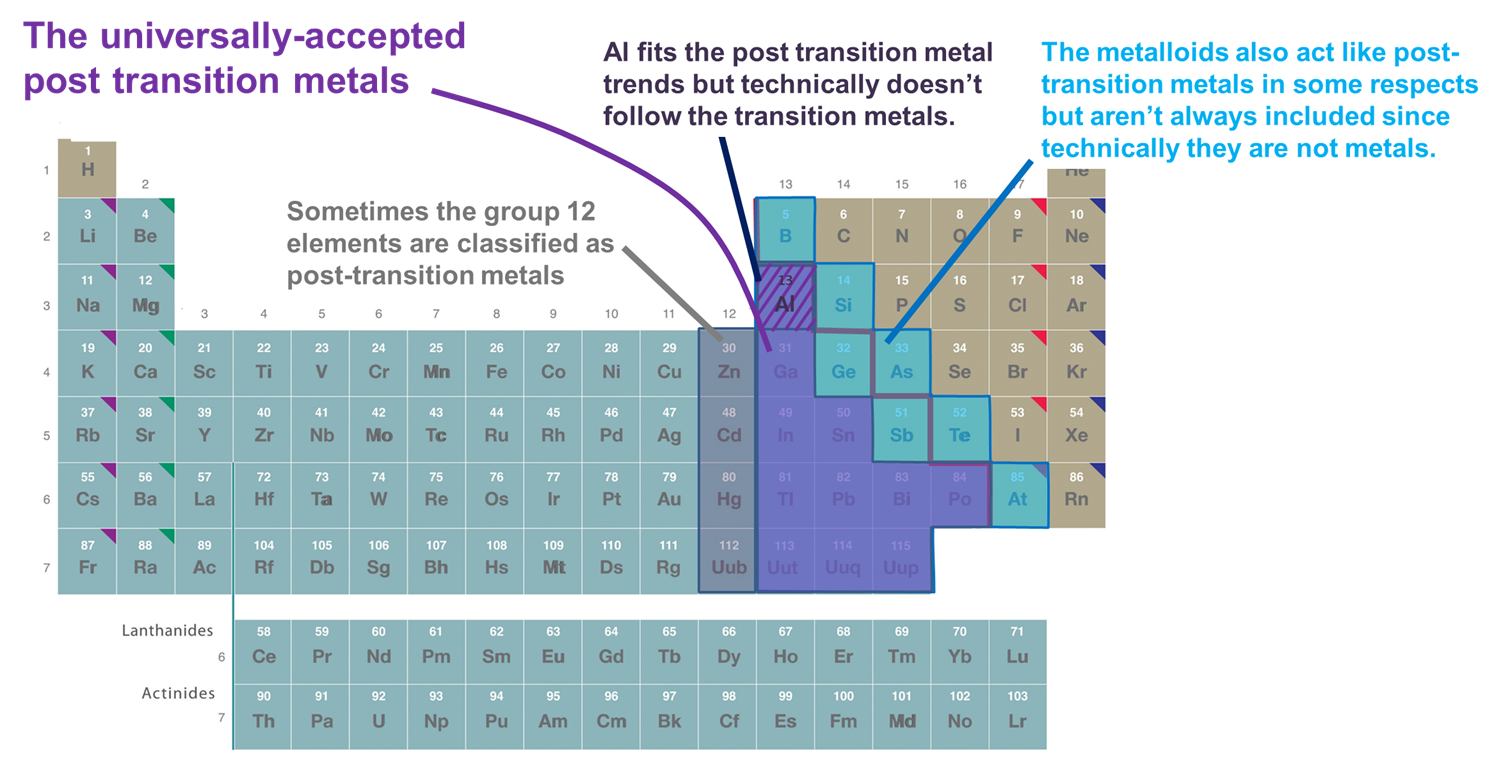
Figura \(\sf{\PageIndex{2}}\). Câteva dintre elementele clasificate ca metale de post tranziție. Cele arătate în violet sunt acceptate în mod obișnuit, deoarece sunt metale și urmează în mod clar metalele de tranziție, în timp ce metalele din grupele 12 (și uneori 11), Al și metaloizii sunt toate incluse uneori, deoarece se comportă ca și celelalte metale de post-tranziție în aspecte importante. Tabelul periodic este adaptat din cel de la https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/02._Atoms%2C_Molecules%2C_and_Ions/2.5%3A_The_Periodic_Table.
.
Lasă un răspuns