Momente de dipol molecular
În moleculele care conțin mai mult de o legătură polară, momentul de dipol molecular este doar combinația vectorială a ceea ce poate fi considerat ca fiind „momente de dipol de legătură” individuale. Din punct de vedere matematic, momentele dipolare sunt vectori; ele posedă atât o mărime, cât și o direcție. Momentul dipolar al unei molecule este, prin urmare, suma vectorială a momentelor dipolare ale legăturilor individuale din moleculă. Dacă momentele dipolare ale legăturilor individuale se anulează reciproc, nu există un moment dipolar net. Acesta este cazul CO2, o moleculă liniară (Figura \(\PageIndex{1a}\)). Fiecare legătură C-O din CO2 este polară, dar experimentele arată că molecula de CO2 nu are niciun moment dipolar. Deoarece cei doi dipoli ai legăturii C-O din CO2 sunt de mărime egală și orientați la 180° unul față de celălalt, aceștia se anulează. Prin urmare, molecula de CO2 nu are niciun moment dipolar net, chiar dacă are o separare substanțială de sarcină. În schimb, molecula de H2O nu este liniară (Figura \(\PageIndex{1b}\)); ea este curbată în spațiul tridimensional, astfel încât momentele dipolare nu se anulează reciproc. Astfel, o moleculă precum H2O are un moment dipolar net. Ne așteptăm ca concentrația de sarcină negativă să fie pe oxigen, atomul cel mai electronegativ, iar sarcina pozitivă pe cei doi hidrogeni. Această polarizare a sarcinii permite H2O să se lege de hidrogen cu alte specii polarizate sau încărcate, inclusiv cu alte molecule de apă.
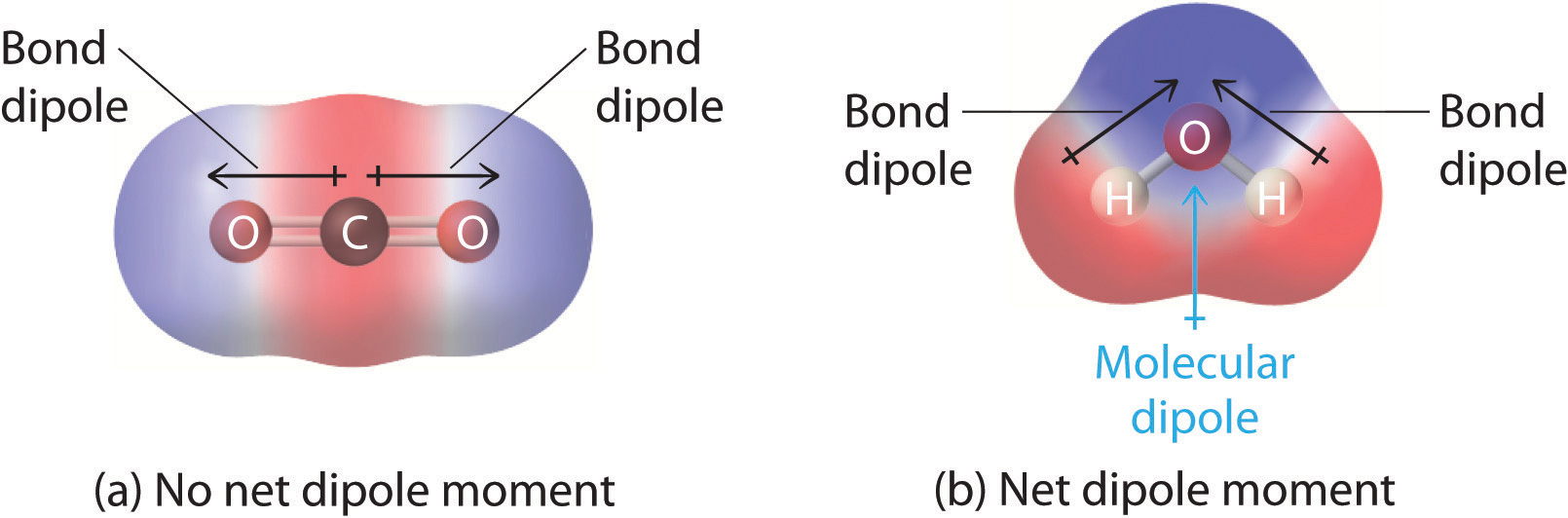
Figura \(\PageIndex{1}\): Cum se adună momentele de dipol de legătură individuale pentru a obține un moment de dipol molecular global pentru două molecule triatomice cu structuri diferite. (a) În CO2, dipolii legăturii C-O sunt egali ca mărime, dar orientați în direcții opuse (la 180°). Suma lor vectorială este zero, astfel încât CO2 nu are, prin urmare, un dipol net. (b) În H2O, dipolii legăturii O-H sunt, de asemenea, egali ca mărime, dar sunt orientați la 104,5° unul față de celălalt. Prin urmare, suma vectorială nu este zero, iar H2O are un moment dipolar net.
Cel de mai jos este o ecuație simplificată pentru un sistem simplu de două sarcini separate care este prezent în moleculele diatomice sau atunci când se ia în considerare un dipol de legătură în cadrul unei molecule.
\
Acest dipol de legătură, µ (grecesc mu) este interpretat ca fiind dipolul provenit dintr-o separare de sarcină pe o distanță \(r\) între sarcinile parțiale \(Q^+\) și \(Q^-\) (sau termenii mai frecvent utilizați \(δ^+\) – \(δ^-\)); orientarea dipolului este de-a lungul axei legăturii. Unitățile de măsură ale momentelor dipolare sunt de obicei debye (D), unde un debye este egal cu 3,336 x 1030 coulombi metri (C – m) în unități SI. Luați în considerare un sistem simplu format dintr-un singur electron și un singur proton separate de o distanță fixă. Sarcina unitară a unui electron este de 1,60 X 1019 C, iar protonul & electronul & se află la o distanță de 100 pm (aproximativ lungimea unei legături covalente tipice), momentul dipolar se calculează astfel:
\ &= (1,60 \ ori 10^{-19}\, C)(1,00 \ ori 10^{-10} \,m) \nonumăr \\\\ &= 1,60 \ ori 10^{-29} \,C \cdot m \label{2} \end{align}\]
\ &= 4.80\; D \label{3} \end{align}\]
\(4,80\; D\) este o valoare de referință cheie și reprezintă o sarcină pură de +1 și -1 separate de 100 pm. Cu toate acestea, dacă separarea sarcinilor ar crește, atunci momentul de dipol crește (liniar):
- Dacă protonul și electronul ar fi separați de 120 pm:
\
- Dacă protonul și electronul au fost separați cu 150 pm:
\
- Dacă protonul și electronul au fost separați cu 200 pm:
\
Exemplu \(\PageIndex{1}\): Apă
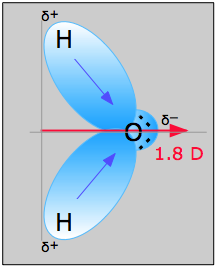
Molcula de apă din figura \(\PageIndex{1}\) poate fi folosită pentru a determina direcția și mărimea momentului de dipol. Pornind de la electronegativitățile oxigenului și hidrogenului, diferența este de 1,2e pentru fiecare dintre legăturile hidrogen-oxigen. În continuare, deoarece oxigenul este atomul mai electronegativ, acesta exercită o atracție mai mare asupra electronilor comuni; de asemenea, are două perechi de electroni solitari. De aici se poate trage concluzia că momentul de dipol se îndreaptă de la cei doi atomi de hidrogen spre atomul de oxigen. Utilizând ecuația de mai sus, momentul dipolar este calculat ca fiind de 1,85 D prin înmulțirea distanței dintre atomii de oxigen și hidrogen cu diferența de sarcină dintre ei și apoi găsirea componentelor fiecăruia care arată în direcția momentului dipolar net (unghiul moleculei este de 104.5˚).
Momentul de legătură al legăturii O-H =1,5 D, deci momentul dipolar net este
\
.
Lasă un răspuns