În reacția cu amoniacul, de ce apa este acidă?
Este o reacție excelentă de chimie generală cu implicații importante în chimia organică. O altă întrebare similară este: de ce este apa o bază atunci când reacționează cu un „acid”? Răspunsul la ambele întrebări este: totul este relativ! Aici, la StudyOrgo, primim frecvent întrebări de acest gen despre subiecte din chimia organică care, de obicei, sunt acoperite rapid, sunt slab descrise sau se așteaptă ca tu să știi de la cursurile anterioare. Aceste concepte sunt cu adevărat importante pentru a înțelege subiectele mai complexe care vor urma. Cu un abonament la StudyOrgo, veți primi și mai multe sfaturi și trucuri despre subiecte de chimie organică și mecanisme detaliate cu explicații. Blogul de astăzi este o avanpremieră a subiectelor detaliate și a materialelor disponibile. Consultați un abonament la StudyOrgo.com și înscrieți-vă astăzi!
Rețineți că, în ceea ce privește acizii și bazele, există două definiții; definiția Bronsted și definiția Lewis. Acizii Bronsted sunt definiți ca donatori de protoni, în timp ce acizii Lewis sunt definiți ca acceptori de electroni. Ambii sunt acizi, dar ceea ce gândim diferit este dacă sunt implicați protoni sau electroni. Într-o soluție apoasă, în chimia generală sau în biochimie, ne gândim în principal la definiția Bronsted, deoarece disocierea protonilor din acizi modifică concentrația de H+ din soluție, pe care o interpretăm ca o modificare a pH-ului și a „acidității” soluției. Măsurăm disocierea protonilor din acizi, sau acceptarea protonilor de către baze, cu o valoare numerică care este pKa. Cu cât pKa este mai mare, cu atât acidul este mai slab și baza mai puternică. Cu cât pKa este mai mic, cu atât acidul este mai puternic și baza mai slabă. Un truc simplu pentru a vă gândi la pKa este să plasați versiunea protonată a moleculei în stânga și să vă gândiți la ea ca la un donator de protoni. PKa vă spune cât de ușoară va fi această donare, cu cât numărul este mai mic, cu atât donarea de protoni este mai ușoară.
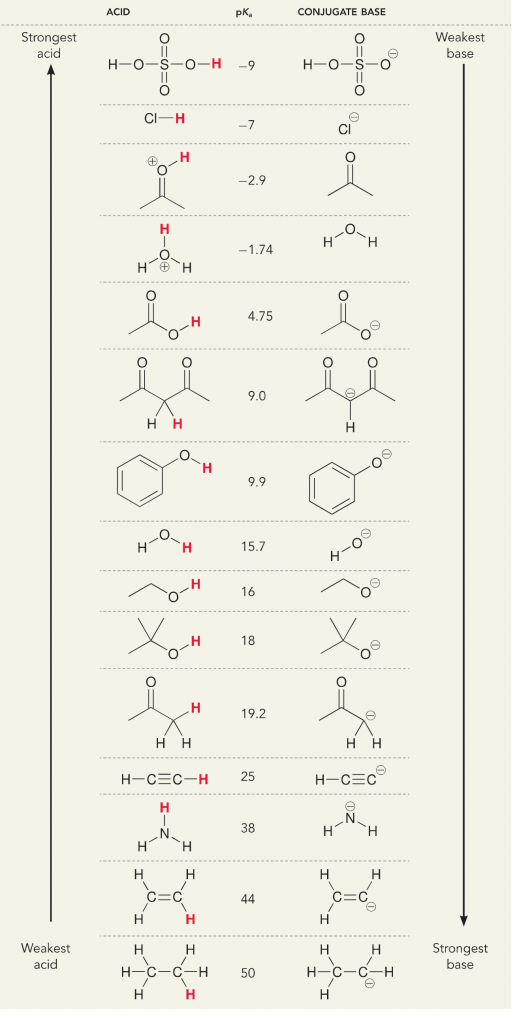
Să ne uităm la reacția dintre amoniac și apă; pKa pentru apă este definit ca fiind 14. PKa pentru amoniac este ~37.
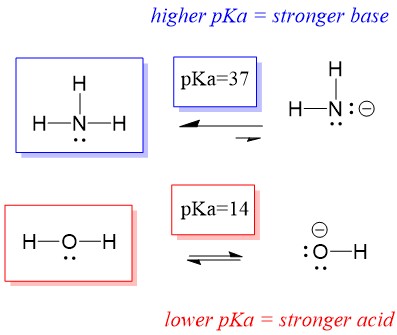
Din acest motiv, deoarece pKa apei este mai mic decât al amoniacului, este un acid mai puternic decât amoniacul și va dona protoni bazei amoniacului. Această reacție face ca apa să devină baza conjugată OH- și amoniacul să devină acidul conjugat NH4+. Interesant, acesta este motivul pentru care amoniacul este un agent caustic, produce hidroxid care reacționează cu petele și microorganismele pentru a curăța și dezinfecta eficient obiectele de uz casnic.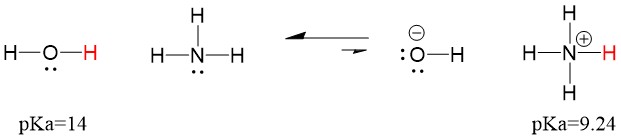
Acest lucru este important ca un concept de chimie organică deoarece puterea acizilor și bazelor în termeni de electroni, sau definiția Lewis, este exact modul în care ne gândim la mecanismele de rupere și formare a legăturilor; fluxul de electroni. Puterea acizilor Lewis și a acidului conjugat poate ajuta la identificarea direcției în care va decurge o reacție. Putem vedea că reacția dintre apă și amoniac este nefavorabilă, dar în realitate are loc o cantitate suficientă de reacție pentru a reduce semnificativ pH-ul apei (pH~11 cu amoniac).
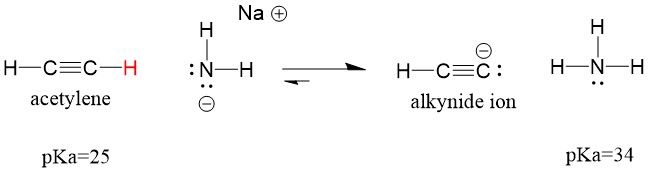
Să ne uităm la o acetilenă care reacționează cu o bază pentru a genera un ion alchinid, un nucleofil util pentru formarea legăturii C-C. Dacă încercăm să facem să reacționeze hidroxidul de sodiu cu alchina, NU se va forma ionul alchină. Acest lucru se datorează faptului că acidul conjugat produs al reacției este apa, care are un pKa de 15, este mai PUTERNIC decât acidul original acetilenă (pKa = 25). Reacțiile favorizează ÎNTOTDEAUNA formarea acidului mai slab, sau, în acest caz, a părții reactante.
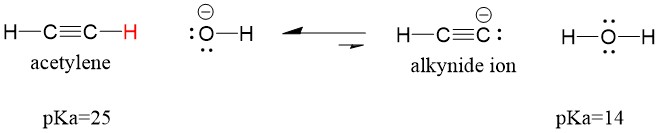
Dacă schimbăm baza noastră cu amida de sodiu, care este o bază mult mai puternică, se va forma ionul alcinidă. Acest lucru se datorează faptului că acidul conjugat produs al reacției este amoniacul, care are un pKa de 38 și este un acid conjugat mai slab decât acidul original acetilenă (pKa = 25). În acest caz, reacția favorizează partea produsului!

Lasă un răspuns