W reakcji z amoniakiem, dlaczego woda jest kwasem?
Jest to świetna reakcja chemii ogólnej z ważnymi implikacjami dla chemii organicznej. Innym podobnym pytaniem jest, dlaczego woda jest zasadą w reakcji z „kwasem”? Odpowiedź na oba pytania brzmi: to wszystko jest względne! Tutaj, w StudyOrgo, często otrzymujemy pytania dotyczące tematów z chemii organicznej, które zazwyczaj są szybko poruszane, słabo opisane lub oczekiwane jako znane z poprzednich kursów. Pojęcia te są naprawdę ważne dla zrozumienia bardziej złożonych tematów. Z członkostwem w StudyOrgo, otrzymasz jeszcze więcej wskazówek i trików na tematy związane z chemią organiczną oraz szczegółowe mechanizmy z wyjaśnieniami. Dzisiejszy blog jest zapowiedzią szczegółowych tematów i dostępnych materiałów. Sprawdź członkostwo w StudyOrgo.com i zapisz się już dziś!
Pamiętaj, że jeśli chodzi o kwasy i zasady, istnieją dwie definicje; definicja Bronsteda i Lewisa. Kwasy Bronsteda są definiowane jako donory protonów, podczas gdy kwasy Lewisa są definiowane jako akceptory elektronów. Oba są kwasami, ale różnimy się tym, czy chodzi o protony czy o elektrony. W roztworze wodnym, w chemii ogólnej lub biochemii, myślimy głównie o definicji Bronsteda, ponieważ dysocjacja protonów z kwasów zmienia stężenie H+ w roztworze, co interpretujemy jako zmianę pH i „kwasowość” roztworu. Dysocjację protonów z kwasów, czyli przyjęcie protonów przez zasady, mierzymy wartością liczbową, którą jest pKa. Im większe pKa, tym słabszy kwas i silniejsza zasada. Im niższe pKa, tym mocniejszy kwas i słabsza zasada. Prostym trikiem na myślenie o pKa jest umieszczenie protonowanej wersji cząsteczki po lewej stronie i myślenie o niej jako o donorze protonów. Wartość pKa mówi, jak łatwe będzie to oddanie, im niższa liczba, tym łatwiejsze oddanie protonu.
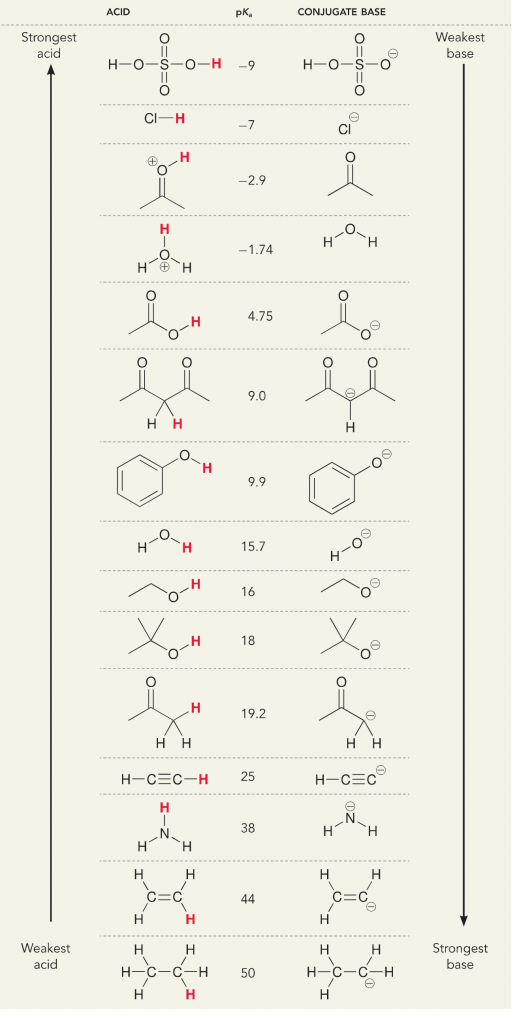
Spójrzmy na reakcję amoniaku i wody; pKa dla wody jest określone jako 14. PKa dla amoniaku wynosi ~37.
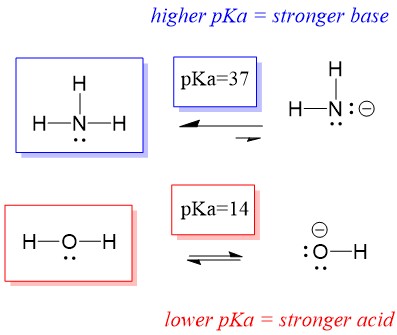
W związku z tym, ponieważ pKa wody jest niższe niż amoniaku, jest ona silniejszym kwasem niż amoniak i będzie oddawać protony do zasady amonowej. Reakcja ta prowadzi do tego, że woda staje się sprzężoną zasadą OH-, a amoniak sprzężonym kwasem NH4+. Co ciekawe, właśnie dlatego amoniak jest środkiem żrącym, wytwarza wodorotlenek, który reaguje z plamami i mikroorganizmami, skutecznie czyszcząc i sanityzując przedmioty domowego użytku.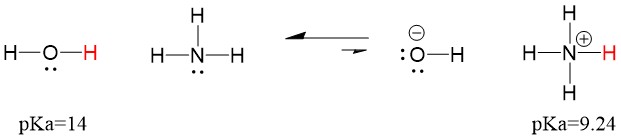
Jest to ważne jako koncepcja chemii organicznej, ponieważ siła kwasów i zasad pod względem elektronów, lub definicja Lewisa, jest dokładnie tym, jak myślimy o mechanizmach zrywania i tworzenia wiązań; przepływ elektronów. Siła kwasów Lewisa i sprzężonych kwasów może pomóc określić, w którym kierunku będzie przebiegać reakcja. Widzimy, że reakcja wody z amoniakiem jest niekorzystna, ale wystarczająco dużo reakcji zachodzi w rzeczywistości, aby znacznie obniżyć pH wody (pH~11 z amoniakiem).
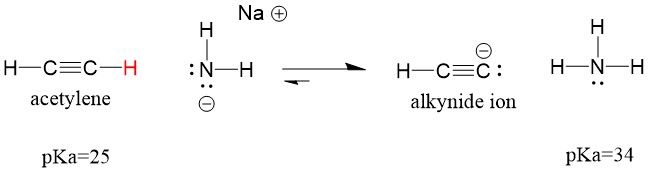
Spójrzmy na acetylen reagujący z zasadą w celu wytworzenia jonu alkilowego, użytecznego nukleofila do tworzenia wiązania C-C. Jeśli spróbujemy przereagować wodorotlenek sodu z alkinem, jon alkinowy NIE powstanie. Dzieje się tak dlatego, że produktem sprzężonego kwasu w reakcji jest woda, która ma pKa = 15, czyli jest SILNIEJSZA niż pierwotny kwas acetylenowy (pKa = 25). Reakcje ZAWSZE sprzyjają powstawaniu słabszego kwasu, czyli w tym przypadku po stronie reagenta.
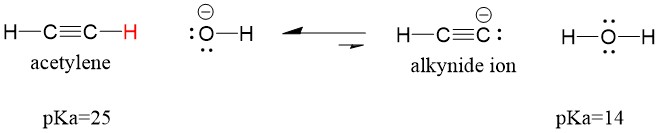
Jeśli zmienimy naszą zasadę na amidek sodu, który jest znacznie silniejszą zasadą, powstanie jon alkinowy. Dzieje się tak dlatego, że produktem sprzężonego kwasu w reakcji jest amoniak, który ma pKa równe 38, a więc jest słabszym kwasem sprzężonym niż pierwotny kwas acetylenowy (pKa = 25). W tym przypadku reakcja faworyzuje stronę produktu!
 .
.
Dodaj komentarz