Siły dipolowe
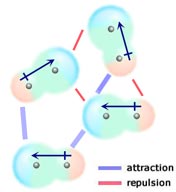
Jeśli dwie neutralne cząsteczki, z których każda posiada stały moment dipolowy, zbliżą się do siebie w taki sposób, że ich przeciwnie naładowane końce ustawią się w jednej linii, będą się do siebie przyciągać. W cieczy lub ciele stałym te ustawienia są preferowane w stosunku do tych, w których podobnie naładowane końce cząsteczek są blisko siebie, a więc odpychają się.
Jednym z powodów, dla których CH3F ma wyższą temperaturę wrzenia (-84 °C) niż CF4 (-128 °C) jest to, że CF3H ma stały moment dipolowy, podczas gdy CF4 nie. Aby to w pełni zrozumieć trzeba wiedzieć, że CF4 ma kształt tetraedryczny, a CH3F jest w przybliżeniu tetraedryczny (nie ma dużej różnicy w kształtach tych cząsteczek). Wiązania węgiel – fluor w obu cząsteczkach są polarne (fluor jest znacznie bardziej elektroujemny niż węgiel), jednak obecność czterech wiązań C-F w tetraedrycznej cząsteczce CF4 sprawia, że cząsteczka jest w sumie niepolarna. Moment dipolowy pojedynczego wiązania C-F w CH3F nie jest niwelowany przez dipole wiązań C-H (które są bardzo małe), więc CH3F ma stały moment dipolowy.
Rodzajem siły międzycząsteczkowej, która może powstać w szczególnych okolicznościach i jest zwykle klasyfikowana jako oddziaływanie dipol-dipol, chociaż ma pewien charakter wiązania kowalencyjnego, jest wiązanie wodorowe.
Dodaj komentarz