|
|
Ten artykuł ma wiele problemów. Pomóż go poprawić lub omów te problemy na stronie dyskusji. (Learn how and when to remove these template messages)
(Learn how and when to remove this template message) |
Monosacharydy (z greckiego monos: pojedynczy, sacchar: cukier), zwane też cukrami prostymi, są najprostszą formą cukru i najbardziej podstawowymi jednostkami (monomerami) węglowodanów. Wzór ogólny to C
nH
2nO
n, aczkolwiek nie wszystkie cząsteczki pasujące do tego wzoru (np. kwas octowy) są węglowodanami. Są one zazwyczaj bezbarwnymi, rozpuszczalnymi w wodzie, krystalicznymi ciałami stałymi. W przeciwieństwie do ich nazwy (cukry), tylko niektóre monosacharydy mają słodki smak.
Przykłady monosacharydów obejmują glukozę (dekstroza), fruktozę (lewuloza) i galaktozę. Monosacharydy są elementami składowymi disacharydów (takich jak sacharoza i laktoza) i polisacharydów (takich jak celuloza i skrobia). Każdy atom węgla, który obsługuje grupę hydroksylową jest chiralny, z wyjątkiem tych na końcu łańcucha. Powoduje to powstanie wielu form izomerycznych, z których wszystkie mają ten sam wzór chemiczny. Na przykład galaktoza i glukoza są zarówno aldoheksozami, ale mają różne struktury fizyczne i właściwości chemiczne.
Glukoza monosacharyd odgrywa kluczową rolę w metabolizmie, gdzie energia chemiczna jest ekstrahowana poprzez glikolizę i cykl kwasu cytrynowego w celu zapewnienia energii organizmom żywym. Niektóre inne monosacharydy mogą być przekształcane w żywym organizmie do glukozy.
Struktura i nomenklatura
Z nielicznymi wyjątkami (np. deoksyryboza), monosacharydy mają taki wzór chemiczny: (CH2O)x, gdzie umownie x ≥ 3. Monosacharydy mogą być klasyfikowane według liczby x atomów węgla, które zawierają: trioza (3), tetroza (4), pentoza (5), heksoza (6), heptoza (7), i tak dalej.
Glukoza, używana jako źródło energii i do syntezy skrobi, glikogenu i celulozy, jest heksozą. Ryboza i deoksyryboza (odpowiednio w RNA i DNA) są cukrami pentozowymi. Przykłady heptoz obejmują ketozy, mannoheptulozę i sedoheptulozę. Monosacharydy z ośmioma lub więcej węglami są rzadko spotykane, ponieważ są dość niestabilne. W roztworach wodnych monosacharydy występują jako pierścienie, jeśli mają więcej niż cztery węgle.
Liniowe monosacharydy
Proste monosacharydy mają liniowy i nierozgałęziony szkielet węglowy z jedną grupą funkcyjną karbonylową (C=O) i jedną grupą hydroksylową (OH) na każdym z pozostałych atomów węgla. Dlatego struktura molekularna prostego monosacharydu może być zapisana jako H(CHOH)n(C=O)(CHOH)mH, gdzie n + 1 + m = x; tak, że jego wzór pierwiastkowy jest CxH2xOx.
Według konwencji, atomy węgla są ponumerowane od 1 do x wzdłuż szkieletu, począwszy od końca, który jest najbliżej grupy C=O. Monosacharydy są najprostszymi jednostkami węglowodanów i najprostszą postacią cukru.
Jeśli karbonyl znajduje się w pozycji 1 (czyli n lub m wynosi zero), cząsteczka zaczyna się od grupy formylowej H(C=O)- i jest technicznie aldehydem. W takim przypadku związek jest określany jako aldoza. W przeciwnym razie, cząsteczka ma grupę ketonową, karbonyl -(C=O)- pomiędzy dwoma węglami; wtedy formalnie jest ketonem i jest określana mianem ketozy. Ketozy o znaczeniu biologicznym zwykle mają karbonyl w pozycji 2.
Różne powyższe klasyfikacje mogą być łączone, co skutkuje nazwami takimi jak „aldoheksoza” i „ketotrioza”.
Nazwa bardziej ogólna dla monosacharydów o otwartych łańcuchach łączy grecki przedrostek wskazujący liczbę węgli (tri-, tetr-, pent-, hex-, itd.) z przyrostkami „-ose” dla aldoz i „-ulose” dla ketoz. W tym ostatnim przypadku, jeżeli karbonyl nie znajduje się w pozycji 2, jego pozycja jest wskazywana przez infiks liczbowy. Tak więc, na przykład, H(C=O)(CHOH)4H jest pentozą, H(CHOH)(C=O)(CHOH)3H jest pentulozą, a H(CHOH)2(C=O)(CHOH)2H jest pent-3-ulozą.
Stereoizomery otwarto-łańcuchowe
Dwa monosacharydy o równoważnych grafach molekularnych (ta sama długość łańcucha i ta sama pozycja karbonylu) mogą nadal być odrębnymi stereoizomerami, których cząsteczki różnią się orientacją przestrzenną. Dzieje się tak tylko wtedy, gdy cząsteczka zawiera centrum stereogeniczne, a konkretnie atom węgla, który jest chiralny (połączony z czterema różnymi podstrukturami molekularnymi). Te cztery wiązania mogą mieć dowolną z dwóch konfiguracji w przestrzeni, rozróżnianych ze względu na ich kierunkowość. W prostym otwartym łańcuchu monosacharydów, każdy węgiel jest chiralny z wyjątkiem pierwszego i ostatniego atomu łańcucha, a (w ketozach) węgiel z grupą keto.
Na przykład, triketoza H(CHOH)(C=O)(CHOH)H (gliceron, dihydroksyaceton) nie ma centrum stereogenicznego, a zatem istnieje jako jeden stereoizomer. Inna trioza, aldoza H(C=O)(CHOH)2H (gliceraldehyd), posiada jeden chiralny węgiel – centralny, numer 2 – który jest związany z grupami -H, -OH, -C(OH)H2 i -(C=O)H. Dlatego też istnieje on jako dwa stereoizomery, których cząsteczki są lustrzanymi odbiciami siebie nawzajem (jak lewa i prawa rękawiczka). Monosacharydy o czterech lub więcej karbonach mogą zawierać wiele chiralnych karbonów, więc zazwyczaj mają więcej niż dwa stereoizomery. Liczba odrębnych stereoizomerów o tym samym schemacie jest ograniczona przez 2c, gdzie c jest całkowitą liczbą chiralnych węgli.
Projekcja Fischera jest systematycznym sposobem rysowania wzoru szkieletowego acyklicznego monosacharydu tak, że rozdrobnienie każdego chiralnego węgla jest dobrze określone. Każdy stereoizomer prostego monosacharydu o otwartym łańcuchu może być zidentyfikowany przez pozycje (prawą lub lewą) w diagramie Fischera chiralnych hydroksyli (hydroksyli dołączonych do chiralnych węgli).
Większość stereoizomerów jest sama w sobie chiralna (różnią się od swoich lustrzanych odbić). W projekcji Fischera, dwa lustrzane izomery różnią się tym, że pozycje wszystkich chiralnych hydroksyli są odwrócone od prawej do lewej. Izomery lustrzanego odbicia są chemicznie identyczne w środowiskach niechiralnych, ale zwykle mają bardzo różne właściwości biochemiczne i występują w przyrodzie.
Podczas gdy większość stereoizomerów może być ułożona w pary form lustrzanego odbicia, istnieją pewne niechiralne stereoizomery, które są identyczne z ich lustrzanymi odbiciami, pomimo posiadania centrów chiralnych. Dzieje się tak zawsze, gdy wykres molekularny jest symetryczny, jak w 3-ketopentozach H(CHOH)2(CO)(CHOH)2H, a dwie połówki są lustrzanymi odbiciami siebie nawzajem. W takim przypadku odbicie lustrzane jest równoważne obrotowi o pół obrotu. Z tego powodu istnieją tylko trzy odrębne stereoizomery 3-ketopentozy, mimo że cząsteczka ma dwa chiralne węgle.
Odrębne stereoizomery, które nie są lustrzanymi odbiciami siebie nawzajem, zwykle mają różne właściwości chemiczne, nawet w środowiskach niechiralnych. Dlatego każdej parze lustrzanej i każdemu niechiralnemu stereoizomerowi można nadać specyficzną nazwę monosacharydu. Na przykład, istnieje 16 różnych stereoizomerów aldoheksozy, ale nazwa „glukoza” oznacza konkretną parę lustrzanych aldoheksoz. W projekcji Fischera, jeden z dwóch izomerów glukozy ma hydroksyl po lewej stronie na C3, a po prawej na C4 i C5; podczas gdy drugi izomer ma odwrotny wzór. Te specyficzne nazwy monosacharydów mają konwencjonalne trzyliterowe skróty, jak „Glu” dla glukozy i „Thr” dla triozy.
Ogólnie, monosacharyd z n asymetrycznymi węglami ma 2n stereoizomerów. Liczba stereoizomerów otwartego łańcucha dla monosacharydu aldozowego jest większa o jeden niż liczba stereoizomerów monosacharydu ketozowego o tej samej długości. Każda ketoza będzie miała 2(n-3) stereoizomery, gdzie n > 2 jest liczbą węgli. Każda aldoza będzie miała 2(n-2) stereoizomery, gdzie n > 2 jest liczbą węgli.Są one również określane jako epimery, które mają różne rozmieszczenie grup -OH i -H przy asymetrycznych lub chiralnych atomach węgla (nie dotyczy to tych węgli posiadających karbonylową grupę funkcyjną).
Konfiguracja monosacharydów
Jak wiele cząsteczek chiralnych, dwa stereoizomery gliceraldehydu będą stopniowo obracać kierunek polaryzacji liniowo spolaryzowanego światła, gdy przechodzi ono przez nie, nawet w roztworze. Te dwa stereoizomery są identyfikowane za pomocą przedrostków D- i L-, zgodnie z sensem rotacji: D-gliceraldehyd jest dekstrotorotacyjny (obraca oś polaryzacji zgodnie z ruchem wskazówek zegara), natomiast L-gliceraldehyd jest leworotacyjny (obraca ją w kierunku przeciwnym do ruchu wskazówek zegara).

Przedrostki D- i L- są również używane z innymi monosacharydami, aby odróżnić dwa szczególne stereoizomery, które są lustrzanymi odbiciami siebie nawzajem. W tym celu rozważa się chiralny węgiel, który jest najbardziej oddalony od grupy C=O. Jego cztery wiązania muszą łączyć się z -H, -OH, -C(OH)H i resztą cząsteczki. Jeżeli cząsteczkę można obrócić w przestrzeni tak, aby kierunki tych czterech grup odpowiadały kierunkom analogicznych grup w C2 D-glicerydy, wówczas izomer otrzymuje przedrostek D-. W przeciwnym razie otrzymuje przedrostek L-.
W projekcji Fischera, przedrostki D- i L- określają konfigurację przy atomie węgla, który jest drugi od dołu: D- jeśli hydroksyl jest po prawej stronie, a L- jeśli jest po lewej stronie.
Zauważ, że przedrostki D- i L- nie wskazują kierunku rotacji światła spolaryzowanego, co jest połączonym efektem układu przy wszystkich centrach chiralnych. Jednakże dwa enancjomery zawsze będą obracać światło w przeciwnych kierunkach, o tę samą wartość. Patrz również układ D/L.
Cyklizacja monosacharydów
Monosacharyd często przechodzi z formy acyklicznej (otwartego łańcucha) do formy cyklicznej, poprzez reakcję addycji nukleofilowej pomiędzy grupą karbonylową i jednym z hydroksyli tej samej cząsteczki. W wyniku tej reakcji powstaje pierścień atomów węgla zamknięty jednym mostkującym atomem tlenu. Powstała cząsteczka ma grupę hemiacetalową lub hemiketalową, w zależności od tego, czy forma liniowa była aldozą czy ketozą. Reakcja jest łatwo odwracalna, dając pierwotną formę otwarto-łańcuchową.
W tych formach cyklicznych pierścień ma zwykle pięć lub sześć atomów. Formy te nazywane są odpowiednio furanozami i piranozami – przez analogię do furanu i piranu, najprostszych związków o takim samym pierścieniu węgiel-tlen (chociaż brakuje im wiązań podwójnych tych dwóch cząsteczek). Na przykład, glukoza aldoheksoza może tworzyć hemiacetalowe wiązanie pomiędzy hydroksylem na węglu 1 i tlenem na węglu 4, dając cząsteczkę z pięcioczłonowym pierścieniem, zwaną glukofuranozą. Ta sama reakcja może zachodzić między węglami 1 i 5, tworząc cząsteczkę z pierścieniem 6-członowym, zwaną glukopiranozą. Formy cykliczne z pierścieniem siedmioatomowym (takim samym jak oksepan), rzadko spotykane, nazywane są heptozami.


.

W przypadku wielu monosacharydów (w tym glukozy), formy cykliczne przeważają, w stanie stałym i w roztworach, i dlatego ta sama nazwa jest powszechnie stosowana do izomerów o otwartym i zamkniętym łańcuchu. Tak więc, na przykład, termin „glukoza” może oznaczać glukofuranozę, glukopiranozę, postać o otwartym łańcuchu lub mieszaninę tych trzech form.
Kyklizacja tworzy nowe centrum stereogeniczne przy węglu przenoszącym karbonyl. Grupa -OH, która zastępuje tlen karbonylu może skończyć się w dwóch różnych pozycjach w stosunku do płaszczyzny środkowej pierścienia. W ten sposób z każdego monosacharydu o otwartym łańcuchu powstają dwa cykliczne izomery (anomery), oznaczane przedrostkami α- i β-. Cząsteczka może przechodzić między tymi dwoma formami w procesie zwanym mutarotacją, który polega na odwróceniu reakcji tworzenia pierścienia, po której następuje ponowne utworzenie pierścienia.
Projekcja Hawortha
Stereochemiczną strukturę cyklicznego monosacharydu można przedstawić w projekcji Hawortha. W tym diagramie, α-izomer dla formy piranozowej D-aldoheksozy ma -OH anomerycznego węgla poniżej płaszczyzny atomów węgla, podczas gdy β-izomer ma -OH anomerycznego węgla powyżej płaszczyzny. Piranozy zazwyczaj przyjmują konformację krzesła, podobną do konformacji cykloheksanu. W tej konformacji, α-izomer ma -OH anomerycznego węgla w pozycji osiowej, podczas gdy β-izomer ma -OH anomerycznego węgla w pozycji równikowej (biorąc pod uwagę cukry D-aldoheksozowe).
-
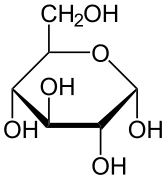
α-D-Glucopyranose

β-.D-Glucopyranose
Pochodne
Istnieje duża liczba biologicznie ważnych zmodyfikowanych monosacharydów:
- Aminocukry takie jak:
- galaktozamina
- glukozamina
- kwas sialowy
- N-acetyloglukozamina
- Sulfosugary takie jak:
- sulfoquinovose
- Inne takie jak:
- kwas askorbinowy
- mannitol
- kwas glukuronowy
Patrz także
- Nomenklatura monosacharydów
- Cukier redukujący
- Kwas cukrowy
- Alkohol cukrowy
- Disacharyd
.
Uwagi
- ^ „Węglowodany”. Chemistry for Biologists. Royal Society of Chemistry. Retrieved 10 March 2017.
- ^ NCERT TEXT BOOK CLaSS-12
- ^ „Carbohydrates”. Chemistry for Biologists. Royal Society of Chemistry. Retrieved 10 March 2017.
- ^ Pigman, William Ward; Anet, E. F. L. J. (1972). „Chapter 4: Mutarotations and Actions of Acids and Bases” (Rozdział 4: Mutarotacje i działania kwasów i zasad). W Pigman i Horton (red.). The Carbohydrates: Chemia i Biochemia. 1A (2nd ed.). San Diego: Academic Press. s. 165-194.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. („Złota Księga”) (1997). Wersja poprawiona online: (2006-) „Haworth representation”. doi:10.1351/goldbook.H02749
.


Dodaj komentarz