Z Proteopedii
proteopedia linkproteopedia link
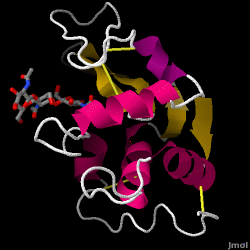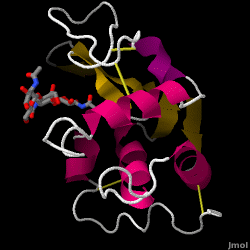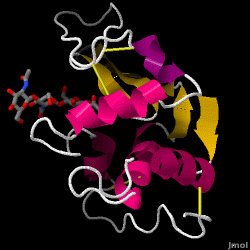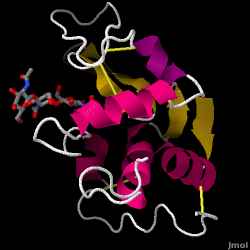
Lizozym – znany również jako muramidaza – jest silnym enzymem występującym w dużych ilościach we łzach, ślinie i ludzkim mleku. U ludzi jest on zakodowany w genie LYZ. Ponieważ jest to małe, łatwo dostępne i bardzo stabilne białko, było ono przedmiotem szeroko zakrojonych badań dotyczących jego funkcji i struktury.
Wprowadzenie
Lizozym działa jako nieswoista obrona przed bakteriami i grzybami. Jest składnikiem wrodzonego układu odpornościowego i stanowi ważny element diety niemowlęcia, aby odeprzeć biegunkę. Jest to enzym znany ze swojej zdolności do degradacji architektury polisacharydowej wielu rodzajów ścian komórkowych, zwykle w celu ochrony przed infekcjami bakteryjnymi. Struktura lizozymu z białka jaja kurzego (HEW), na którym skupimy się w tym artykule, przedstawiona jest po prawej stronie. Aktywność antybakteryjna białka jaja kurzego została po raz pierwszy opisana przez Laschtschenko w 1909 roku. Została ona scharakteryzowana i nazwana „lizozymem” przez Alexandra Fleminga, tego samego, któremu przypisuje się odkrycie penicyliny. Odkrycie aktywności enzymatycznej było dziełem przypadku; podczas niepowiązanego eksperymentu, przez nieuwagę wprowadzono krople z nosa do szalki Petriego zawierającej kulturę bakteryjną, która to kultura w konsekwencji wykazywała wyniki nieznanej jeszcze reakcji enzymatycznej. Obserwacja tej nieznanej reakcji doprowadziła do dalszych badań nad składnikami tej reakcji, jak również do odpowiedniej identyfikacji nowo odkrytego „lizozymu”. W 1965 r. David C. Phillips i współpracownicy określili trójwymiarową strukturę lizozymu w rozdzielczości 2 Å . Praca Phillipsa była szczególnie przełomowa, ponieważ Phillipsowi udało się z powodzeniem wyjaśnić strukturę enzymu za pomocą krystalografii rentgenowskiej – było to osiągnięcie, którego nigdy wcześniej nie udało się dokonać. Badania Phillipsa doprowadziły również do opartej na strukturze hipotezy jego mechanizmu działania.
Funkcja
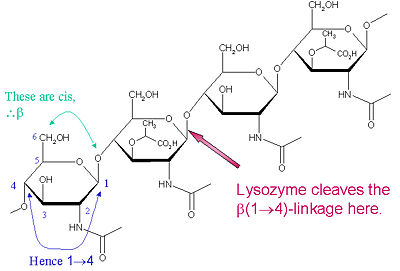
Szczególnym substratem preferowanym dla tego typu rozszczepienia jest (NAG-NAM)₃ heksasacharyd, w obrębie którego występuje docelowe wiązanie glikozydowe rozszczepiające, NAM₄-β-O-NAG₅. Poszczególne jednostki wiążące heksasacharydy są oznaczone A-F, z preferencją rozszczepiania wiązania glikozydowego NAM₄-β-O-NAG₅ odpowiadającą jednostce D-E wiązania glikozydowego cl
Lizozym jest znany z uszkadzania bakteryjnych ścian komórkowych poprzez katalizowanie hydrolizy 1,4-beta-linki pomiędzy resztami kwasu N-acetylomuraminowego (NAM) i N-acetylo-D-glukozaminy (NAG) w peptydoglikanie oraz pomiędzy resztami N-acetylo-D-glukozaminy w chitodekstrynach. W ten sposób lizozym jest skuteczny w lizie ścian komórkowych zarówno bakterii, jak i grzybów. Miejscem rozszczepienia lizozymu w tym motywie architektonicznym jest wiązanie glikozydowe β(1-4) łączące węgiel C1 NAM z węglem C4 NAG.
Szczególnym substratem preferowanym dla tego typu rozszczepienia jest heksasacharyd (NAG-NAM)₃, w obrębie którego występuje docelowe wiązanie glikozydowe, NAM₄-β-O-NAG₅. Poszczególne jednostki wiążące heksasacharydy są oznaczone A-F, przy czym preferencja rozszczepiania wiązania glikozydowego NAM₄-β-O-NAG₅ odpowiada preferencji rozszczepiania wiązania glikozydowego jednostki D-E. W zależności od organizmu, z którego otrzymywany jest lizozym, hydroliza wiązania glikozydowego przebiega z zachowaniem konfiguracji przy węglu anomerycznym (białko jaja kurzego) lub z inwersją (gęś, fag T4).
Lizozym wydajnie działa na długie (NAG-NAM) lub (NAG) polimery. Gdy długość łańcucha staje się mniejsza niż sześć monomerów, szybkość katalityczna znacznie spada; w rzeczywistości trisacharydy działają jako inhibitory kompetycyjne, wiążąc się z miejscem aktywnym w rejestrze nieprodukcyjnym.
Lizozym z białka jaja kurzego (kod PDB 1hew)
Mechanizm
Hydroliza wiązań glikozydowych przez lizozym białka jaja kurzego przebiega z zachowaniem konfiguracji. W 1953 roku Koshland zasugerował, że ogólnie rzecz biorąc, zachowanie konfiguracji implikuje mechanizm podwójnego przemieszczenia (podczas gdy odwrócenie konfiguracji implikuje pojedyncze przemieszczenie). Przez dziesięciolecia rozważano dwie konkurencyjne hipotezy mechanistyczne (Phillips: mechanizm dysocjacyjny z pośrednikiem oksokarbenowym; Koshland: dwuetapowy mechanizm asocjacyjny z kowalencyjnym kompleksem enzymatycznym jako pośrednikiem), przy czym dane z 2001 r. przechylają szalę w kierunku istnienia kowalencyjnego pośrednika. Brak struktury kompleksu substratowego z pewnością przyczynił się do trudności w rozróżnieniu możliwych mechanizmów, podobnie jak istnienie dwóch odrębnych mechanizmów (retencji i inwersji konfiguracji) w obrębie tej samej rodziny strukturalnej enzymów (np. enzym kury vs enzym gęsi).
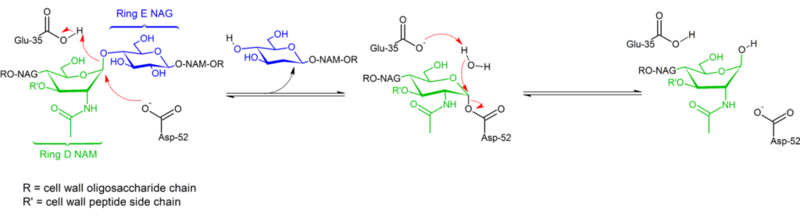
Lizozym hydrolizuje glikozyd (stąd rodzinna klasyfikacja lizozymu jako glikozylazy), co odpowiada przekształceniu acetalu w hemiacetal. Reakcja przebiega w dwóch etapach, jak pokazano na rysunku powyżej. W pierwszym etapie Asp 52 działa jako nukleofil, a część cukru jest grupą opuszczającą. W drugim etapie, woda działa jako nukleofil, a Asp 52 jako grupa opuszczająca. Oba etapy odwracają konfigurację przy węglu anomerycznym, co prowadzi do ogólnego zachowania konfiguracji. Glu 35 działa jako kwas w pierwszym etapie (protonując cukier w wiązaniu glikozydowym, aby uczynić go lepszym elektropolem) i jako zasada w drugim etapie (deprotonując wodę, aby uczynić ją lepszym nukleofilem). Podczas gdy rysunek pokazuje niektóre z cukrów w konformacji łodzi, aby podkreślić odwrócenie konfiguracji, nie są one obserwowane doświadczalnie, ale raczej znajdują się w konformacji krzesła.
Zastosowania lizozymu
Odkąd lizozym został powszechnie uznany za swoje właściwości przeciwbakteryjne i przeciwgrzybicze, ma szeroką gamę zastosowań zarówno w biochemii, jak i farmacji. W biologii molekularnej lizozym jest często używany w procedurze alkalicznej do ekstrakcji i izolacji plazmidowego DNA. Jest on szeroko stosowany w farmacji do niszczenia bakterii Gram-dodatnich i może być wykorzystywany do wspomagania już istniejącej obrony immunologicznej w walce z infekcjami bakteryjnymi. Enzym ten jest szczególnie ważny w zapobieganiu chorobom bakteryjnym u niemowląt. Ze względu na swoje właściwości antybakteryjne lizozym może być również stosowany w przemyśle spożywczym, aby zapobiec psuciu się żywności.
Zobacz także
- Struktury 3D lizozymu
- Lizozym
- Hydrolazy glikozydowe zatrzymujące
- Molekularny Plac Zabaw/Lizozym
- Użytkownik:Judy Voet/Lizozym
- Lizozym (arabski)
- Lizozym (hebrajski)
- Ragland SA, Criss AK. Od bakteryjnego zabijania do immunologicznej modulacji: Recent insights into the functions of lysozyme. PLoS Pathog. 2017 Sep 21;13(9):e1006512. doi: 10.1371/journal.ppat.1006512., eCollection 2017 Sep. PMID:28934357 doi:http://dx.doi.org/10.1371/journal.ppat.1006512
- Laschtschenko,P. (1909)Über die keimtötende und entwicklungshemmende Wirkung von Hühnereiweiss. Z. Hyg. Infektionskrankh.,64,419-427.
- Fleming, A. (1922) On a remarkable bacteriolytic element found in tissues and secretions. Proc.Roy.Soc.(London),93,306-317.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Bugg, T. 1997. An Introduction to Enzyme and Coenzyme Chemistry. Blackwell Science Ltd., Oxford
- Earliest Solutions for Macromolecular Crystal Structures.
- 7.0 7.1 Blake CC, Johnson LN, Mair GA, North AC, Phillips DC, Sarma VR. Crystallographic studies of the activity of hen egg-white lysozyme. Proc R Soc Lond B Biol Sci. 1967 Apr 18;167(1009):378-88. doi:, 10.1098/rspb.1967.0035. PMID:4382801 doi:http://dx.doi.org/10.1098/rspb.1967.0035
- Image from: http://www.vuw.ac.nz/staff/paul_teesdale-spittle/essentials/chapter-6/proteins/lysozyme.htm
- Richardson JS. Wczesne rysunki wstążki z białek. Nat Struct Biol. 2000 Aug;7(8):624-5. doi: 10.1038/77912. PMID:10932243 doi:http://dx.doi.org/10.1038/77912
- http://mcdb-webarchive.mcdb.ucsb.edu/sears/biochemistry/tw-enz/lysozyme/HEWL/lysozyme-overview.htm
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution. Nature. 1965 May 22;206(986):757-61. PMID:5891407
- Johnson LN, Phillips DC. Structure of some crystalline lysozyme-inhibitor complexes determined by X-ray analysis at 6 Angstrom resolution. Nature. 1965 May 22;206(986):761-3. PMID:5840126
- Phillips (1966) Scientific American 215, 76-90
- 14.0 14.1 Vocadlo DJ, Davies GJ, Laine R, Withers SG. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate. Nature. 2001 Aug 23;412(6849):835-8. PMID:11518970 doi:10.1038/35090602
- Davies, Withers and Vocadlo (2009) The Chitopentaose Complex of a Mutant Hen Egg-White Lysozyme Displays No Distortion of the -1 Sugar Away from a 4C1 Chair Conformation, Australian Journal of Chemistry 62(6) 528-532
- Koshland, D. E. (1953). Biol. Rev. 28, 416-436
- https://bio.libretexts.org/Bookshelves/Biochemistry/Book%3A_Biochemistry_Online_(Jakubowski)/07%3A_CATALYSIS/B._Mechanisms_of_Enzyme-Catalyzed_Reactions/B2.__Lysozyme
Proteopedia Page Contributors and Editors (co to jest?)
Karsten Theis, Anne Goodling, Michal Harel, Alexander Berchansky, Eric Martz, Karl Oberholser, Joel L. Sussman, Jaime Prilusky, John Ripollone, Daniel Kreider, Judy Voet, John S. de Banzie
.
Dodaj komentarz