Słowa kluczowe
CADASIL – udar mózgu – rezonans magnetyczny
Wprowadzenie
Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leucoencephalopathy (CADASIL) jest dziedziczną chorobą małych tętnic spowodowaną różnymi patogenetycznymi mutacjami genu NOTCH-3. Charakteryzuje się występowaniem migreny z aurą, objawami psychiatrycznymi, nawracającymi w młodym wieku incydentami niedokrwiennymi i zaburzeniami funkcji poznawczych. Te cechy oraz typowe dla niej wyniki badań radiologicznych są tym, co zwykle pomaga nam podejrzewać tę chorobę. Zwykle uważa się, że jest to choroba osób młodych i w średnim wieku, ale przypadki u osób starszych mogą być niedostatecznie rozpoznane. Przedstawiamy przypadek mężczyzny, u którego rozpoznano CADASIL w późnych latach siedemdziesiątych dzięki wcześniejszej diagnozie u jego córki.
Raporty przypadków
Przypadek 1
Córka naszego pacjenta miała 50 lat, kiedy została skierowana do naszego szpitala z poradni neurologicznej w celu dalszych badań, ze względu na wyniki radiologiczne w jej badaniu MRI mózgu, które polegały na zmianach w istocie białej w obu kapsułach zewnętrznych, obustronnych obszarach okołokomorowych i lewym płacie skroniowym.
Uczęszczała do wyżej wymienionej kliniki, ponieważ cierpiała na migrenę z aurą wzrokową od 30 lat, z niektórymi epizodami sugerującymi aurę wzrokową bez bólu głowy. Nie miała innych objawów. Była uczulona na fosfomycynę i przeszła tonsillektomię w dzieciństwie. Nie miała innej historii medycznej. Historia jej rodziny była niezwykła: jej matka miała migrenę i łagodną demencję, a jej ojciec miał udar w wieku 75 lat; jej dziadek ze strony ojca, wujek i ciotka mieli udary, a u wujka zdiagnozowano chorobę Alzheimera, kuzyn ze strony ojca otrzymał gdzie indziej diagnozę „ANA+ zapalenie naczyń”, a u innego kuzyna ze strony ojca zdiagnozowano stwardnienie rozsiane. Miała dwóch zdrowych synów. Badanie fizykalne, w tym dokładna eksploracja neurologiczna, było całkowicie prawidłowe. Powtórzone badanie MRI mózgu wykazało liczne hiperintensywne zmiany w istocie białej tylnej wypukłości, obszarach okołokomorowych i podkorowych, w tym przednich płatach skroniowych, szczególnie lewym, obu centrach półkulowych, wewnętrznych i zewnętrznych kapsułach, bez oznak niedawnych lub przeszłych mikrokrwawień (ryc. 1). Wszystkie pozostałe badania, w tym hemogram, glukemia, czynność wątroby i nerek, wskaźnik sedymentacji erytrocytów, stężenie hormonów tarczycy w surowicy, badanie przesiewowe w kierunku nadkrzepliwości, badanie przesiewowe w kierunku zapalenia naczyń, EKG, RTG klatki piersiowej, badania serologiczne w kierunku kiły i HIV oraz ultrasonografia pni nadaortalnych z Dopplerem, były prawidłowe, z wyjątkiem cholesterolemii 220 mg/dl z cholesterolem LDL 152 mg/dl. Biopsja skóry była również prawidłowa. W czwartym eksonie genu NOTCH 3 stwierdzono mutację Arg169Cys (substytucja cytozyny na tyminę w kodonie 505), o której wiadomo, że jest patogenetyczna, dlatego u pacjentki rozpoznano CADASIL. Z tym rozpoznaniem oboje rodzice byli oceniani w naszej klinice.
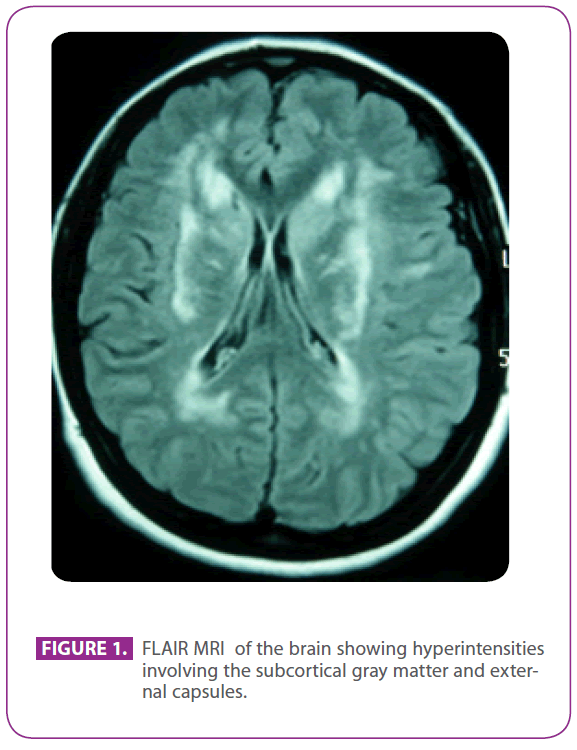
Rycina 1: FLAIR MRI mózgu pokazujący hiperintensje obejmujące podkorową istotę szarą i kapsuły zewnętrzne.
Przypadek 2
Matka miała 78 lat. Miała długą historię migreny bez aury, a w ciągu ostatnich dwóch lat rozwinęła łagodną demencję z symetrycznym parkinsonizmem, fluktuacjami i zaburzeniami zachowania podczas snu REM, sugerującymi demencję z ciałami Lewy’ego. Rezonans magnetyczny mózgu wykluczył istotną chorobę istoty białej.
Jej ojciec był 79-letnim mężczyzną z kilkoma naczyniowymi czynnikami ryzyka: cukrzycą typu 2, dyslipidemią i paleniem od 50 lat, ze skumulowanym wskaźnikiem 15 paczko-lat, chociaż rzucił palenie 3 lata temu. Chorował na chorobę niedokrwienną serca z zawałem serca ściany tylnej dolnej w 1991 roku. W ciągu ostatnich 8 lat miał trzy przemijające incydenty niedokrwienne i udar lakunarny odpowiadające różnym obszarom tętnic, z postępującym upośledzeniem chodu, a w ciągu ostatnich 6 miesięcy stał się nieco wycofany i apatyczny. Nie stwierdzono migreny w wywiadzie. Przyjmował metforminę, klopidogrel, atenolol i atorwastatynę. W badaniu przedmiotowym był przytomny i zorientowany, ale nieco nieuważny, język oraz pamięć odległa i niedawna były w normie, wykazywał apraksję ideomotoryczną, zmienioną interpretację podobieństw i powiedzeń, bez odruchów czołowych uwalniających. Stwierdzono również globalną hiperrefleksję z obustronnym zgięciowym odruchem podeszwowym, chód z krótkimi krokami i ograniczonymi ruchami ramion. Tomografia komputerowa wykonana dwa lata wcześniej, po jednym z jego przemijających ataków niedokrwiennych, wykazała rozległą chorobę istoty białej, szczególnie widoczną w torebce zewnętrznej i płatach skroniowych (ryc. 2).
Podsumowując, pacjent miał nawracające udary niedokrwienne, łagodne podkorowe zaburzenia poznawcze i leukoencefalopatię, wysoce podejrzane o CADASIL, biorąc pod uwagę diagnozę jego córki. Wykonano badanie genetyczne, które wykazało tę samą mutację NOTCH 3 co u córki i potwierdziło diagnozę.
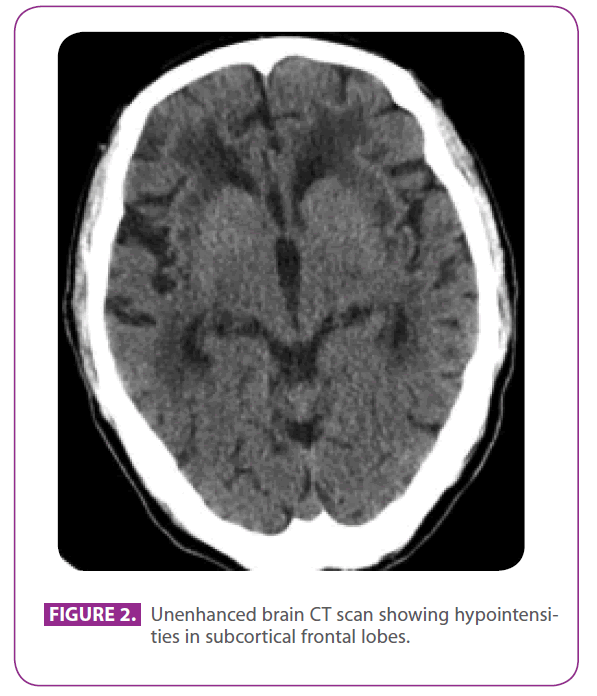
Rysunek 2: Niewzmocniona tomografia komputerowa mózgu pokazująca hipointensywność w podkorowych płatach czołowych.
Dyskusja
CADASIL jest najczęstszą dziedziczną chorobą małych naczyń. Może jednak występować również sporadycznie, gdyż opisywano mutacje de novo. Jest ona spowodowana różnymi patogennymi mutacjami w genie NOTCH-3, który jest zlokalizowany w chromosomie 19, locus 19p13.2-p13.1, i składa się z 33 eksonów, które kodują białko o długości 2321 aminokwasów (1). Białko to jest jednoprzejściowym transmembranowym receptorem powierzchni komórkowej, ulegającym ekspresji w komórkach mięśni gładkich tętnic systemowych, z zewnątrzkomórkową domeną regulatorową i wewnątrzkomórkową domeną transduktorową. Dotychczas opisano ponad 190 mutacji, które mogą prowadzić do CADASIL, a wszystkie one występują w eksonach od 2 do 24 genu NOTCH 3, które kodują 34 powtórzenia podobne do naskórkowego czynnika wzrostu w zewnątrzkomórkowej części NOTCH 3. Dlatego badanie przesiewowe tych 23 eksonów ma 100% czułość i prawie taką samą specyficzność (2). Spośród tych mutacji, ponad 180 to mutacje typu missense, co najmniej 6 delecji, jedna insercja, jedna zmiana ramki i 2 duplikacje. Większość patogenetycznych mutacji NOTCH3 występuje w eksonach 3 i 4 (3).
Wszystkie mutacje powodują dodanie lub utratę reszty cysteinowej w powtórzeniu podobnym do EGF, a zatem nieparzystą liczbę reszt cysteinowych, co powoduje tworzenie nieprawidłowych mostków disulfidowych. Zmutowany NOTCH3 powoduje degenerację komórek gładkich naczyń w małych tętnicach i tętniczkach oraz akumulację nieprawidłowego białka w ścianie tych naczyń, co prowadzi do zwężenia światła (1). W mózgu dotyczy to tętnic mózgowych i leptomeningealnych, prowokując niezdolność tych naczyń do autoregulacji i hipoperfuzję obszarów przez nie nawadnianych, a w konsekwencji zawały w istocie białej.
Pierwszym objawem CADASIL, gdy się pojawia, jest zwykle migrena z aurą, ze średnim wiekiem wystąpienia 30 lat. Pojawia się ona u 20 do 40% pacjentów (4). Większość ataków jest typowa z aurą wzrokową lub czuciową, ale połowa pacjentów ma również ataki nietypowe z aurą podstawną, hemiplegiczną lub przedłużoną.
Podkorowe zdarzenia niedokrwienne, przejściowe ataki lub udary, pojawiają się u 60 do 85% pacjentów, pierwszy z nich w średnim wieku 50 lat, chociaż może wystąpić już w drugiej dekadzie. W większości przypadków nie występują konwencjonalne naczyniowe czynniki ryzyka lub są one mało istotne. U 2/3 pacjentów incydenty niedokrwienne objawiają się klinicznie i radiologicznie jako zespoły lakunarne. U większości pacjentów dochodzi do kilku udarów, zwykle od 2 do 5, które w ciągu kilku lat prowadzą do trudności w chodzeniu, nietrzymania moczu i stolca, demencji i porażenia rzekomobulwarowego (1). Zaburzenia funkcji poznawczych są drugą co do częstości manifestacją kliniczną. Najwcześniejszym objawem jest zwykle upośledzenie zdolności wykonawczych i szybkości przetwarzania, które występuje u większości pacjentów powyżej 35 roku życia, ale może pojawić się już w pierwszej dekadzie życia (5). Zaburzenia funkcji poznawczych mają charakter postępujący i zwykle pogarszają się wraz z kolejnymi udarami, z dodatkowym upośledzeniem czynności instrumentalnych, pamięci, języka, rozumowania i zdolności wzrokowo-przestrzennych. W szóstej dekadzie życia u ponad 70% pacjentów występuje otępienie. Ciężka afazja, apraksja lub agnozja są rzadkie w CADASIL.
Zaburzenia psychiczne, głównie zaburzenia nastroju, występują u 20% pacjentów, na ogół jako ciężkie epizody depresyjne. Apatia występuje u 40% pacjentów i nie ma związku z depresją. Inne, rzadsze objawy kliniczne to ostra odwracalna encefalopatia (6) (u 10% pacjentów), w większości przypadków występująca po migrenie z aurą, napady drgawkowe (u 5 do 10% pacjentów), głuchota, parkinsonizm, krwotoki mózgowe (głównie u pacjentów z nadciśnieniem tętniczym) i zawał mięśnia sercowego.
Mimo całkowitej penetracji, CADASIL charakteryzuje się istotną między- i wewnątrzpochodną zmiennością ekspresji klinicznej. Ta sama mutacja NOTCH-3 ma szerokie spektrum kliniczne, bez wyraźnych różnic między pacjentami homozygotycznymi i heterozygotycznymi. W rzeczywistości nie ma korelacji pomiędzy genotypem a fenotypem klinicznym (4). Przyczyna tych różnic nie jest znana, ale opisano pewne możliwe czynniki modyfikujące fenotyp CADASIL, takie jak aktualne palenie tytoniu dla ryzyka udaru i wieku wystąpienia pierwszego udaru, wysokie ciśnienie krwi dla ryzyka udaru, czy poziom homocysteiny dla wieku wystąpienia migreny (3,4). Te i inne czynniki mogą wpływać na ekspresję kliniczną choroby poprzez modyfikację ekspresji genów lub poprzez wpływ na inne szlaki fizjopatologiczne, które mogą prowadzić do takich samych manifestacji klinicznych.
Zmiany radiologiczne pojawiają się u wszystkich osób z mutacją CADASIL przed 35 rokiem życia i narastają z czasem. Najwcześniejszą i najczęstszą cechą są hiperintensywne, niewzmacniające się obszary punkcikowate w istocie białej mózgu i strukturach podkorowych w obrazach MRI ważonych T2 i obrazach fluid-attenuated inversion recovery. Zajęcie torebek zewnętrznych i przedniej części płatów skroniowych jest typowe dla tej choroby i stanowi wskazówkę diagnostyczną, ponieważ pomaga w diagnostyce różnicowej z innymi schorzeniami, takimi jak choroba małych naczyń (1).
CADASIL jest powszechnie uważany za chorobę młodych i w średnim wieku dorosłych, ale liczba starszych pacjentów może być niedostatecznie zdiagnozowana (7,8). Nasz drugi przypadek może służyć jako przykład: 79-letni pacjent z naczyniowymi czynnikami ryzyka i nawracającymi udarami, z chorobą istoty białej, która była uważana za wtórną do choroby małych naczyń przez kilku neurologów. Diagnoza została postawiona dopiero po uzyskaniu informacji o mutacji jego córki. W przypadkach bez jasnego wywiadu rodzinnego, otwarty umysł i uważna uwaga na sugestywne wyniki radiologiczne, takie jak zajęcie torebki zewnętrznej lub przednich płatów skroniowych, mogą być jedyną wskazówką dla prawidłowej diagnozy.
- Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Cadasil. Lancet Neurol 2009; 8:643-53.
- Vazquez do Campo R, Morales-Vidal S, Randolph C, Chadwick L, Biller J. CADASIL: a case series of 11 patients. Rev Neurol. 2011; 52:202-10.
- Adib-Samii P, Brice G, Martin RJ, Markus HS. Clinical spectrum of CADASIL and the effect of cardiovascular risk factors on phenotype: study in 200 consecutively recruited individuals. Stroke 2010; 4:630-4.
- Singhal S, Bevan S, Barrick T, Rich P, Markus HS. The influence of genetic and cardiovascular risk factors on the CADASIL phenotype. Brain. 2004; 127:2031-8.
- Dichgans M, Markus HS, Salloway S, Verkkoniemi A, Moline M, Wang Q, Posner H, Chabriat HS. Donepezil in patients with subcortical vascular cognitive impairment: a randomised double-blind trial in CADASIL. Lancet Neurol. 2008;7:310-8.
- Schon F, Martin RJ, Prevett M, Clough C, Enevoldson TP, Markus HS. „CADASIL coma”: an underdiagnosed acute encephalopathy. J Neurol Neurosurg Psychiatry. 2003;74:249-52.
- Liem MK, Lesnik Oberstein SA, Vollebregt MJ, Middelkoop HA, van der Grond J, Helderman-van den Enden AT. Homozygotyczność dla mutacji NOTCH3 u 65-letniego pacjenta z CADASIL z łagodnymi objawami: doniesienie rodzinne. J Neurol. 2008 ;255:1978-80.
- Lee YC, Yang AH, Soong BW. The remarkably variable expressivity of CADASIL: report of a minimally symptomatic man at an advanced age. J Neurol. 2009;256:1026-7
Dodaj komentarz