Results
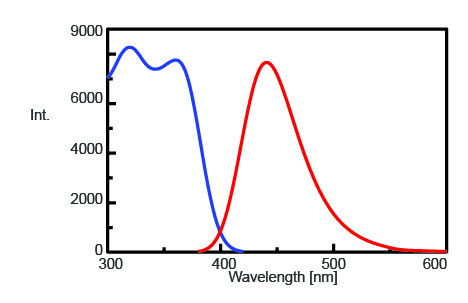
Aby znaleźć maksymalną długość fali emisji w celu monitorowania intensywności fluorescencji AMC po rozszczepieniu trypsyny, zmierzono widma wzbudzenia i emisji, które przedstawiono na rysunku 1. Stwierdzono, że maksymalna długość fali emisji wynosi 440 nm.
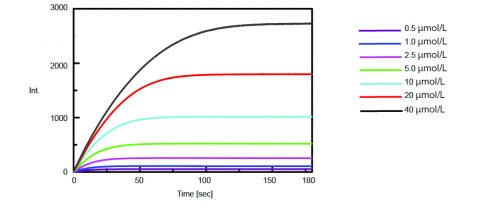
Aby znormalizować zmierzoną intensywność fluorescencji roztworu enzymu do stężenia wyizolowanego AMC, wykonano miareczkowanie i zmierzono fluorescencję. 0,5 ml porcji roztworu AMC o stężeniu 50 µmol/L dodano do 2,5 ml roztworu enzymu, a początkowe i końcowe stężenia wyizolowanego AMC zestawiono w tabeli 1.
Tabela 1. Stężenia wyizolowanej AMC przed i po standaryzacji intensywności fluorescencji.
| Stężenie początkowe | 3 | 6 | 15 | 30 | 60 | 120 | 240 |
| Stężenie końcowe | 0.5 | 1 | 2,5 | 5 | 10 | 20 | 40 |
Kinetykę aktywności trypsyny uzyskano mierząc intensywność fluorescencji wyizolowanej AMC po rozszczepieniu trypsyny od substratu. Rysunek 2 przedstawia pomiar przebiegu czasowego po dodaniu 0,5 mL różnych stężeń roztworu substratu Boc-Gln-Ala-Arg-MCA do 2,5 mL roztworu enzymu.
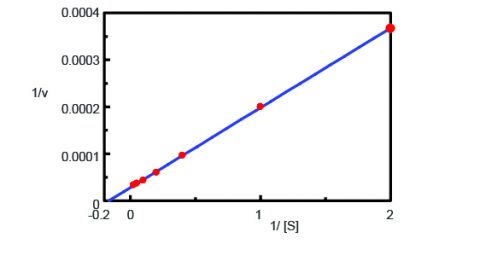
Używając programu Kinetics Analysis, wykreślono wykres Lineweavera-Burka (Rysunek 3) na podstawie pomiarów przebiegu fluorescencji w czasie na Rysunku 2. Wykres Lineweavera-Burka dostarcza parametrów kinetycznych enzymu, takich jak maksymalna szybkość reakcji, Vmax, i stała Michaelisa-Mentena, Km. Vmax opisuje szybkość reakcji, gdy enzym jest nasycony substratem, natomiast Km wskazuje ilość substratu potrzebną do osiągnięcia maksymalnej szybkości reakcji. Vmax wyniosła 35,270 nmol/L-min-1, a Km – 5,99. Równanie linii wynosiło 1/v = 0,000270 – 1/ + 0,0000284.
.
Dodaj komentarz