Co mają wspólnego minipreparaty DNA i eksperymenty immunoprecypitacji białek? Zaczynają się inaczej, ale kończą się tym samym, krytycznym etapem – elucją. Ale czym dokładnie jest elucja i o co w niej chodzi?
Terminologia
Po pierwsze, zacznijmy od podstawowej terminologii:
Elucja – wyodrębnienie jednego materiału z drugiego przez przemycie rozpuszczalnikiem.
Asorbent – faza stała, którą może być żel krzemionkowy w przypadku kolumn mini-prep, ale zazwyczaj są to kulki, które mogą być kowalencyjnie połączone z przeciwciałami lub innymi cząsteczkami ligandów. „Faza stała” nie musi oznaczać kolumny stojącej; mogą to być kulki w eppendorfie, które można łatwo umyć.
Powinowactwo – miara zdolności absorbentu do wiązania wybranej cząsteczki (tego, co próbuje się wymyć). Im wyższe powinowactwo fazy stałej do wybranej biomolekuły (BOC), tym ściślej cząsteczka ta wiąże się z nią. Nie chcemy jednak, aby wiązanie było nieodwracalne; uniemożliwi to elucję.
Eluent – rozpuszczalnik, który usuwa BOC z absorbentu.
Eluat – rozpuszczalnik zawierający BOC usunięty z adsorbentu.
Przygotowanie materiału
Przed elucją należy zaabsorbować wybraną cząsteczkę, pozbywając się jednocześnie zanieczyszczeń. Jest to niezbędny krok, ponieważ konwencjonalna mądrość przypomina nam „garbage in, garbage out”. Możesz mieć doskonałe odczynniki do elucji, ale jeśli twoja próbka zawiera zbyt dużo niezwiązanego personelu (termin naukowy to „gunk”), to zatka on materiał adsorpcyjny. Nasycenie fazy stałej uniemożliwi wchłonięcie Twojego BOC, a następnie zanieczyści eluat. Skuteczne etapy lizy i oczyszczania są niezbędne dla powodzenia eksperymentu elucji.
Ważne jest określenie objętości materiału do wstępnej absorpcji. Objętość lizatu, która przechodzi przez medium absorpcyjne nie powinna przekraczać 3 – 5 objętości kolumny. Duża objętość lizatu przechodzącego przez absorbent wydłuża czas eksperymentu, jak również zwiększa prawdopodobieństwo absorpcji śmieci. W wielu przypadkach warto zmniejszyć początkową objętość lizatu poprzez filtrację lub frakcjonowanie. Tak więc, objętość lizatu określa rozmiar kolumny.
Wybór materiału adsorpcyjnego zależy od składu chemicznego interesującej nas cząsteczki. Absorpcja biomolekuł zwykle wiąże się z mniej lub bardziej specyficzną interakcją pomiędzy substratem a cząsteczką. Na przykład, DNA jest absorbowane na minikolumnach dzięki interakcji jonowej pomiędzy ujemnie naładowanymi grupami fosforanowymi DNA i dodatnio naładowanymi cząsteczkami krzemionki.
Białka są zwykle adsorbowane na sefarozie lub kulkach magnetycznych pokrytych IgG.
Po wstępnym zastosowaniu lizatu, w żadnym momencie kolumna nie może wyschnąć. Spowoduje to „przypieczenie” cząsteczki do absorbentu i zaburzy integralność kolumny. Jeśli nie masz czasu na kontynuowanie eksperymentu, uzupełnij kolumnę kompatybilnym buforem i zatrzymaj przepływ.
Mycie
Celem mycia fazy stałej jest usunięcie niezwiązanego z nią materiału, przy jednoczesnym pozostawieniu interesującej Cię cząsteczki na kolumnie. Selektywny rozdział jest często osiągany przez zastosowanie buforu o niskiej sile jonowej (np. niskie stężenie soli). Objętość buforu płuczącego powinna być zbliżona do ilości materiału wyjściowego i wynosić co najmniej 3-5 objętości kolumny.
Jednakże po przepuszczeniu przez kolumnę kilku objętości buforu płuczącego zanieczyszczenia zostaną wypłukane, a dodatkowe płukanie nie poprawi jakości preparatu. Co więcej, zaczniesz tracić swój materiał docelowy.
Elucja
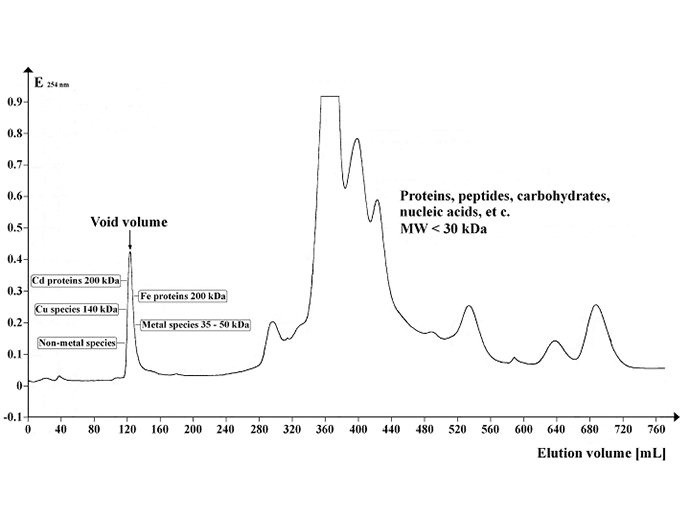
Obraz: Chromatogram przedstawiający profil absorpcji UV supernatantu Arabidopsis rozdzielonego na Sephadex G-50 Superfine. Objętość żelu: 500 mL; długość kolumny: 700 mm; średnica kolumny: 30 mm; szybkość przepływu eluentu: 12 mL / hr; objętość frakcji: 8,0 mL; liczba frakcji: 95; objętość próbki: 5 mL; temperatura separacji: 4 °C; bufor elucyjny: 20 mM Tris-HCl, 1 mM NaN3; pH 8,0. Image credit: https://commons.wikimedia.org/wiki/File:Chrom_SephG-50.tif
Elucja sama w sobie działa, ponieważ zaburzamy wiązania pomiędzy kolumną a substratem (tj. poprzez użycie wysokiej soli lub wysokiej temperatury eluentu). Elucja jest zwykle wykonywana w małej objętości buforu zgodnego z przechowywaniem próbki i dalszymi zastosowaniami.
Elucja DNA z kolumny mini-prep jest najprostszym przypadkiem: jedna objętość buforu usuwa prawie całe DNA. Stężenie DNA w eluacie jest odwrotnie proporcjonalne do użytego buforu elucyjnego: im więcej buforu użyjesz, tym mniejsze będzie końcowe stężenie DNA. Jednak nawet w tym przypadku większość producentów zaleca użycie dodatkowej objętości w celu usunięcia całego DNA.
W przypadku kolumn prędkość elucji jest krytyczna. Zbyt wolna prędkość zwiększy szanse degradacji cząsteczki; zbyt szybka i nie będzie rozdzielczości frakcji.
W przypadku kolumn o dużej objętości, należy zebrać frakcje eluatu, ponieważ cząsteczka będzie rozprowadzana pomiędzy nimi. Pierwsza frakcja będzie zawierała mieszaninę buforu płuczącego i elucyjnego oraz możliwe zanieczyszczenia nieusunięte przez bufor płuczący.
Można monitorować OD dla danego typu cząsteczki (260nm/280nm dla DNA) i wykonać blot dla określonego stężenia cząsteczki w każdej frakcji. W najprostszym przypadku rozkład cząsteczek będzie miał kształt prostej krzywej dzwonowej, ale może mieć jeden lub więcej ostrych szczytów.
Podsumowując, znajomość podstawowych parametrów eksperymentu (absorbent, rozmiar kolumny, bufor płuczący, bufor elucyjny, szybkość przepływu, liczba frakcji) i ogólnych zasad elucji pozwoli Ci na pomyślne ustawienie elucji.
Aby uzyskać więcej szczegółów, znajdź artykuł, w którym inni naukowcy zrobili coś podobnego – najlepiej tę samą cząsteczkę, ale podobną – i dostosuj do swoich warunków.
.
Dodaj komentarz