14.8 Etery
Cele nauczania
- Opisać różnicę strukturalną między alkoholem a eterem, która wpływa na właściwości fizyczne i reaktywność każdego z nich.
- Nazwać proste etery.
- Opisać budowę i zastosowania niektórych eterów.
O wzorze ogólnym ROR′, eterZwiązek organiczny, który posiada atom tlenu pomiędzy dwoma grupami węglowodorowymi. może być uważany za pochodną wody, w której oba atomy wodoru są zastąpione grupami alkilowymi lub arylowymi. Może być również uważany za pochodną alkoholu (ROH), w którym atom wodoru grupy OH jest zastąpiony przez drugą grupę alkilową lub arylową:
HOH→Atomy H zastępują obaROR′←grupy OH zastępują atom HROH
Proste etery mają proste nazwy zwyczajowe, utworzone z nazw grup przyłączonych do atomu tlenu, po których następuje nazwa rodzajowa eteru. Na przykład CH3-O-CH2CH2CH3 to eter metylowo-propylowy. Jeżeli obie grupy są takie same, nazwa grupy powinna być poprzedzona przedrostkiem di-, jak w eterze dimetylowym (CH3-O-CH3) i eterze dietylowym CH3CH2-O-CH2CH3.
Cząsteczki eteru nie mają atomu wodoru na atomie tlenu (czyli nie mają grupy OH). Dlatego nie ma międzycząsteczkowe wiązanie wodoru między cząsteczkami eteru, a etery dlatego mają dość niskie temperatury wrzenia dla danej masy molowej. Rzeczywiście, etery mają punkty wrzenia około takie same jak te z alkanów o porównywalnej masie molowej i znacznie niższe niż te z odpowiednich alkoholi (Tabela 14.4 „Porównanie punktów wrzenia alkanów, alkoholi i eterów”).
Table 14.4 Comparison of Boiling Points of Alkanes, Alcohols, and Ethers
| Condensed Structural Formula | Name | Molar Mass | Boiling Point (°C) | Intermolecular Hydrogen Bonding in Pure Liquid? | |
|---|---|---|---|---|---|
| CH3CH2CH3 | propan | 44 | -42 | nie | |
| CH3OCH3 | eter dimetylowy | 46 | -25 | nie | |
| CH3CH2OH | alkohol etylowy | 46 | 78 | tak | |
| CH3CH2CH2CH3 | pentan | 72 | 36 | nie | |
| CH3CH2OCH2CH3 | eter dwuetylowy | 74 | 35 | nie | nie |
| CH3CH2CH2CH2OH | alkohol butylowy | 74 | 117 | tak |
Cząsteczki eteru mają atom tlenu, jednak, i angażują się w wiązanie wodorowe z cząsteczkami wody. W konsekwencji, eter ma około taką samą rozpuszczalność w wodzie jak alkohol, który jest izomeryczny z nim. Na przykład, eter dimetylowy i etanol (oba o wzorze cząsteczkowym C2H6O) są całkowicie rozpuszczalne w wodzie, podczas gdy eter dietylowy i 1-butanol (oba C4H10O) są ledwo rozpuszczalne w wodzie (8 g/100 mL wody).
Przykład 5
Jaka jest wspólna nazwa dla każdego eteru?
- CH3CH2CH2OCH2CH3
-
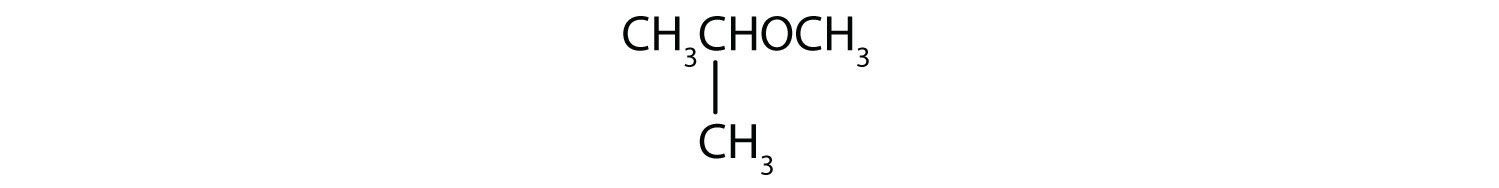
Rozwiązanie
- Grupy węglowe po obu stronach atomu tlenu to grupy propylowe (CH3CH2CH2), więc związek jest eterem dipropylowym.
- Trójwęglowa grupa jest dołączona przez środkowy atom węgla, więc jest to grupa izopropylowa. Grupa jednowęglowa jest grupą metylową. Związek ten to eter izopropylometylowy.
Ćwiczenie rozwijające umiejętności
-
CH3CH2CH2CH2OCH2CH2CH3
-
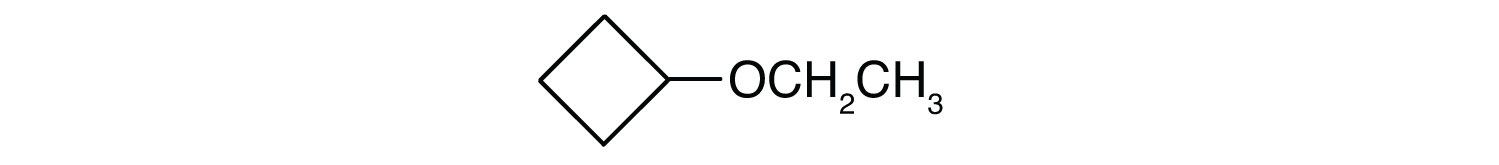
Jaka jest nazwa zwyczajowa każdego eteru?
To Your Health: Ethers as General Anesthetics
A general anesthetic acts on the brain to produce unconsciousness and a general insensitivity to feeling or pain. Eter dietylowy (CH3CH2OCH2CH3) był pierwszym stosowanym środkiem znieczulenia ogólnego.
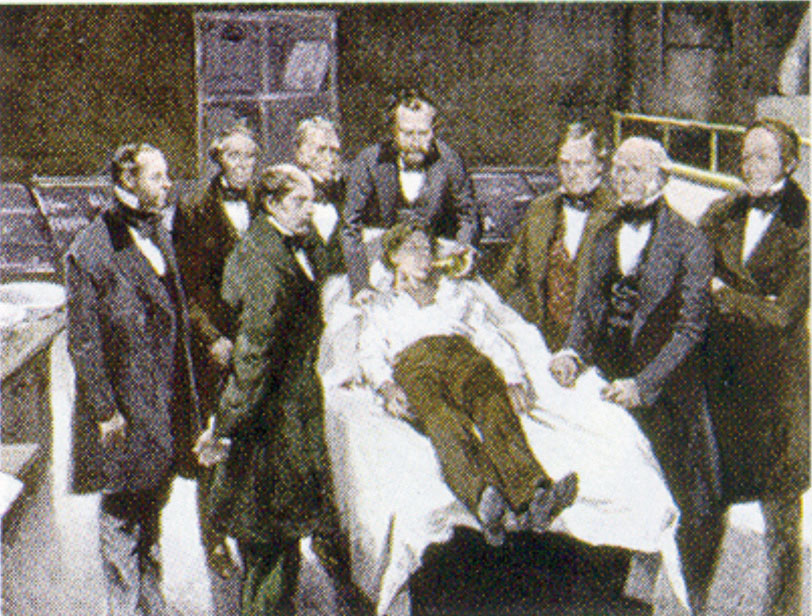
William Morton, dentysta z Bostonu, wprowadził eter dietylowy do praktyki chirurgicznej w 1846 roku. Ten obraz przedstawia operację przeprowadzoną w Bostonie w 1846 roku, podczas której eter dietylowy został użyty jako środek znieczulający. Wdychanie oparów eteru powoduje utratę przytomności poprzez obniżenie aktywności ośrodkowego układu nerwowego.
Source: Painting of William Morton by Ernest Board, from http://commons.wikimedia.org/wiki/File:Morton_Ether_1846.jpg.
Eter dietylowy jest stosunkowo bezpieczny, ponieważ istnieje dość duża różnica między dawką, która wywołuje skuteczny poziom znieczulenia, a dawką śmiertelną. Ponieważ jednak jest wysoce łatwopalny i ma dodatkową wadę w postaci wywoływania mdłości, został zastąpiony nowszymi anestetykami wziewnymi, w tym związkami zawierającymi fluor: halotanem, enfluranem i izofluranem. Niestety, bezpieczeństwo tych związków dla personelu sali operacyjnej zostało zakwestionowane. Na przykład, kobiety pracujące na sali operacyjnej narażone na halotan cierpią na wyższy wskaźnik poronień niż kobiety w populacji ogólnej.
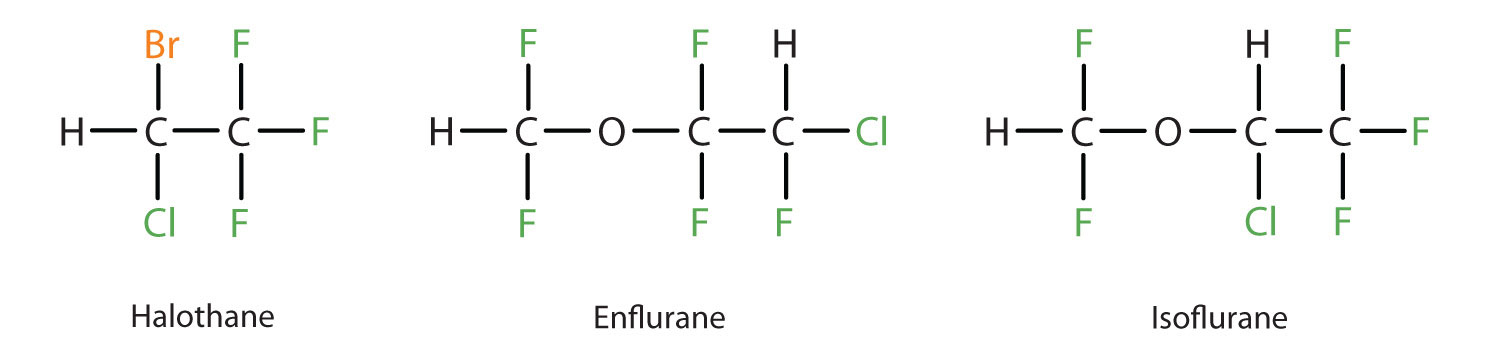
Te trzy nowoczesne, wziewne, zawierające halogeny, związki anestetyczne są mniej łatwopalne niż eter dietylowy.
Ćwiczenia sprawdzające pojęcia
-
Dlaczego eter dietylowy (CH3CH2OCH2CH3) ma znacznie niższą temperaturę wrzenia niż 1-butanol (CH3CH2CH2CH2OH)?
-
Który z nich jest bardziej rozpuszczalny w wodzie – eter metyloetylowy (CH3CH2OCH3) czy 1-butanol (CH3CH2CH2CH2OH)? Explain.
Answers
-
Eter dietylowy nie ma międzycząsteczkowego wiązania wodorowego, ponieważ nie ma grupy OH; 1-butanol ma OH i angażuje się w międzycząsteczkowe wiązanie wodorowe.
-
Eter metylowy eteru etylowego (trzy atomy węgla, jeden atom tlenu) jest bardziej rozpuszczalny w wodzie niż 1-butanol (cztery atomy węgla, jeden atom tlenu), mimo że oba mogą angażować się w wiązanie wodorowe z wodą.
Key Takeaways
- Aby nadać eterom wspólne nazwy, wystarczy nazwać grupy dołączone do atomu tlenu, a następnie nazwę ogólną eter. Jeśli obie grupy są takie same, nazwa grupy powinna być poprzedzona przedrostkiem di-.
- Cząsteczki eterów nie mają grupy OH, a zatem nie mają międzycząsteczkowego wiązania wodorowego. Etery mają zatem dość niskie temperatury wrzenia dla danej masy molowej.
- Cząsteczki eteru mają atom tlenu i mogą angażować się w wiązanie wodorowe z cząsteczkami wody. Cząsteczka eteru ma mniej więcej taką samą rozpuszczalność w wodzie jak izomeryczny z nią alkohol.
Ćwiczenia
-
Jak etanol może dawać dwa różne produkty podczas ogrzewania z kwasem siarkowym? Nazwij te produkty.
-
Który z tych eterów jest izomeryczny z etanolem-CH3CH2OCH2CH3, CH3OCH2CH3, czy CH3OCH3?
-
Nazwij każdy związek.
- CH3OCH2CH2CH3
-
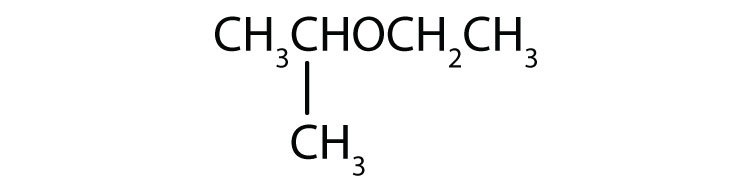
-
Nazwij każdy związek.
- CH3CH2CH2CH2OCH3
-
Narysuj strukturę dla każdego związku.
- eter etylowy metylu
- eter etylowy tert-butylowy
-
Narysuj strukturę dla każdego związku.
- eter diizopropylowy
- eter cyklopropylopropylowy
Odpowiedzi
-
Wewnątrzcząsteczkowa (zarówno H jak i OH pochodzą z tej samej cząsteczki) dehydratacja daje etylen; międzycząsteczkowa (H pochodzi z jednej cząsteczki, a OH z innej) dehydratacja daje eter dietylowy.
-
- eter metylowo-propylowy
- eter izopropylowy etylu
.
-
- CH3OCH2CH3
-
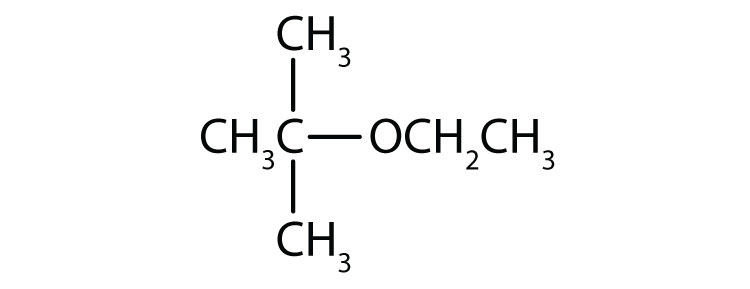
.
Dodaj komentarz